Nature子刊!磷酸化iTRAQ助力PDAC疾病機制研究!
信息來源:金開瑞 作者:genecreate 發布時間:2019-04-04 11:58:29
題目:Exome-wide analysis identifies three low-frequency missense variants associated with pancreatic cancer risk in Chinese populations
期刊:Nature Communications
影響因子:12.353
合作技術:磷酸化iTRAQ
研究背景
胰腺導管腺癌(PDAC)是最致命的人類癌癥之一,在世界范圍內,PDAC的發病率逐年增加,5年生存率僅為5%,在可治愈階段的預防或早期診斷仍然非常困難。目前對于PDAC的種系編碼變異尚未得到系統的研究,因此,增加對PDAC易感性的其他低頻或罕見變異的鑒定將有助于加深對該疾病病因的理解。
研究內容及結果
1. PDAC鑒定三個低頻錯義SNP
在該研究的發現階段,作者對943名PDAC患者和3098名健康對照者進行了外顯子組關聯分析(圖1),其中25個變體表現出有希望的關聯。因此,作者選擇這25種變體進一步分析,最終確定了三種與PDAC風險顯著相關的低頻編碼變體,并通過邏輯回歸分析中的加性模型顯示P值達到全基因組顯著性。其中,rs34309238最為顯著,它位于染色體19p13.12 中PKN1的第11外顯子;DOK2的第4個外顯子中的rs2242241變體和APOB的第28個外顯子中的rs183117027變體也與PDAC的風險增加相關(圖2)。
期刊:Nature Communications
影響因子:12.353
合作技術:磷酸化iTRAQ
研究背景
胰腺導管腺癌(PDAC)是最致命的人類癌癥之一,在世界范圍內,PDAC的發病率逐年增加,5年生存率僅為5%,在可治愈階段的預防或早期診斷仍然非常困難。目前對于PDAC的種系編碼變異尚未得到系統的研究,因此,增加對PDAC易感性的其他低頻或罕見變異的鑒定將有助于加深對該疾病病因的理解。
研究內容及結果
1. PDAC鑒定三個低頻錯義SNP
在該研究的發現階段,作者對943名PDAC患者和3098名健康對照者進行了外顯子組關聯分析(圖1),其中25個變體表現出有希望的關聯。因此,作者選擇這25種變體進一步分析,最終確定了三種與PDAC風險顯著相關的低頻編碼變體,并通過邏輯回歸分析中的加性模型顯示P值達到全基因組顯著性。其中,rs34309238最為顯著,它位于染色體19p13.12 中PKN1的第11外顯子;DOK2的第4個外顯子中的rs2242241變體和APOB的第28個外顯子中的rs183117027變體也與PDAC的風險增加相關(圖2)。
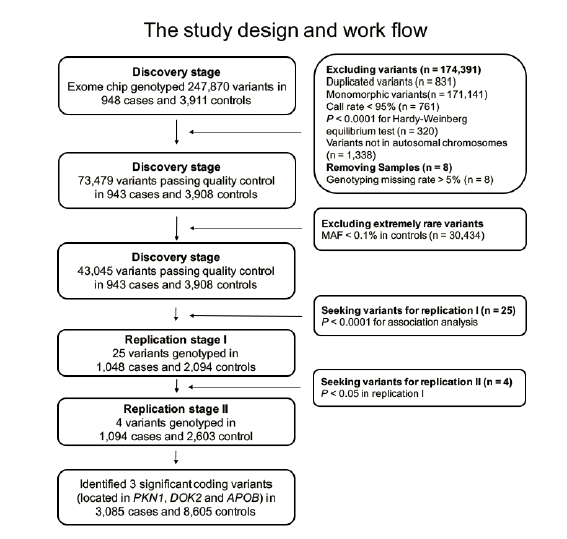
圖1 技術路線
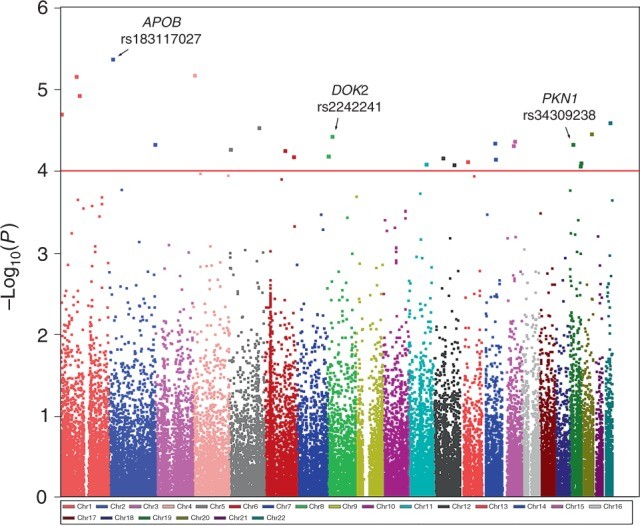
圖2 遺傳變異和胰腺癌風險之間關聯分析
2. rs34309238變體可能影響PKN1磷酸化
在已確定的三個變體中,作者預測rs34309238變體(Leu555Ile)PKN1可能具有破壞性,并且已報道的三個磷酸化位點(S559、S561和S562)位于該變體附近,因此它們的磷酸化水平可能受到影響(圖3a)。此外,作者通過對Oncomine數據庫和人類蛋白質Atlas數據庫分析發現,PKN1在許多癌癥中表達上調,如神經膠質瘤、腎癌、卵巢癌、前列腺癌和PDAC。因此,作者推測rs34309238 C>A 變化可能通過影響磷酸化PKN1的水平并激活下游信號傳導途徑而影響PDAC發病風險。
在已確定的三個變體中,作者預測rs34309238變體(Leu555Ile)PKN1可能具有破壞性,并且已報道的三個磷酸化位點(S559、S561和S562)位于該變體附近,因此它們的磷酸化水平可能受到影響(圖3a)。此外,作者通過對Oncomine數據庫和人類蛋白質Atlas數據庫分析發現,PKN1在許多癌癥中表達上調,如神經膠質瘤、腎癌、卵巢癌、前列腺癌和PDAC。因此,作者推測rs34309238 C>A 變化可能通過影響磷酸化PKN1的水平并激活下游信號傳導途徑而影響PDAC發病風險。
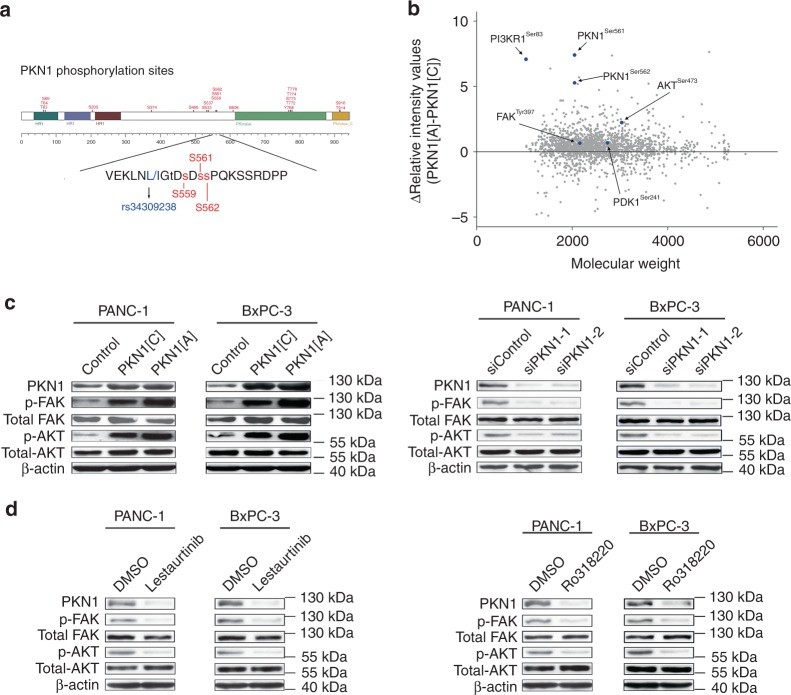
圖3 PKN1 rs34309238變體通過改變磷酸化PKN1的水平并影響FAK / PI3K / AKT信號傳導途徑來影響胰腺癌風險
3. rs34309238-A激活PKN1 / FAK / PI3K / AKT途徑
為了闡明rs34309238在PDAC發展中的作用,作者使用含有PKN1 rs34309238 [C]、 rs34309238 [A]的pcDNA3.1質粒轉染PANC-1細胞,并進行磷酸化iTRAQ相對定量蛋白質組學分析。結果發現和PKN1 [C]組、對照載體組相比,PKN1 [A]中Ser561和Ser562磷酸化水平增加。此外,FAK(FAK Tyr397)、PI3K調節亞基α(PI3KR1 Ser83)、3-磷酸肌醇依賴性蛋白激酶1(PDK1 Ser241)以及PKN1 [A]轉染后的絲氨酸/蘇氨酸激酶1(AKT Ser473)的磷酸化水平皆有所增加(圖3b)。WB實驗進一步驗證了FAK Tyr397和AKT Ser473的磷酸化水平增加結果(圖3c)。同時,siRNA敲低PKN1后可以降低磷酸化FAK Tyr397和AKT Ser473水平(圖3c)。
4. rs34309238-A促進PDAC細胞增殖
為了進一步表征PKN1變體在PDAC細胞中的功能,作者在PANC-1和BxPC-3細胞中過表達不同的PKN1變體并檢測細胞增殖速率。結果發現與過表達PKN1 [C]組、對照載體組相比,過表達PKN1 [A]可以顯著促進PANC-1和BxPC-3細胞的增殖(圖4a,b);敲低PKN1則會抑制PANC-1和BxPC-3細胞的增殖(圖4c,d)。此外,作者還選擇了兩個已報道的PKN1抑制劑(Lestaurtinib、Ro318220)并驗證它們是否可以抑制PDAC細胞的增殖。結果顯示,Lestaurtinib和Ro318220均通過降低磷酸化FAK / PI3K / AKT水平來抑制PANC-1和BxPC-3細胞的增殖(圖3d和圖4e、f)。
為了闡明rs34309238在PDAC發展中的作用,作者使用含有PKN1 rs34309238 [C]、 rs34309238 [A]的pcDNA3.1質粒轉染PANC-1細胞,并進行磷酸化iTRAQ相對定量蛋白質組學分析。結果發現和PKN1 [C]組、對照載體組相比,PKN1 [A]中Ser561和Ser562磷酸化水平增加。此外,FAK(FAK Tyr397)、PI3K調節亞基α(PI3KR1 Ser83)、3-磷酸肌醇依賴性蛋白激酶1(PDK1 Ser241)以及PKN1 [A]轉染后的絲氨酸/蘇氨酸激酶1(AKT Ser473)的磷酸化水平皆有所增加(圖3b)。WB實驗進一步驗證了FAK Tyr397和AKT Ser473的磷酸化水平增加結果(圖3c)。同時,siRNA敲低PKN1后可以降低磷酸化FAK Tyr397和AKT Ser473水平(圖3c)。
4. rs34309238-A促進PDAC細胞增殖
為了進一步表征PKN1變體在PDAC細胞中的功能,作者在PANC-1和BxPC-3細胞中過表達不同的PKN1變體并檢測細胞增殖速率。結果發現與過表達PKN1 [C]組、對照載體組相比,過表達PKN1 [A]可以顯著促進PANC-1和BxPC-3細胞的增殖(圖4a,b);敲低PKN1則會抑制PANC-1和BxPC-3細胞的增殖(圖4c,d)。此外,作者還選擇了兩個已報道的PKN1抑制劑(Lestaurtinib、Ro318220)并驗證它們是否可以抑制PDAC細胞的增殖。結果顯示,Lestaurtinib和Ro318220均通過降低磷酸化FAK / PI3K / AKT水平來抑制PANC-1和BxPC-3細胞的增殖(圖3d和圖4e、f)。
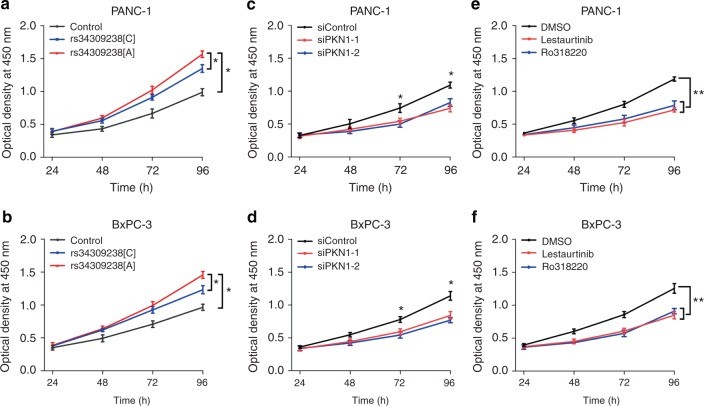
圖4 PKN1 rs34309238變體對胰腺癌細胞增殖影響
文章小結
在本研究中,作者使用Illumina HumanExome Beadchip對PDAC的編碼易感基因位點進行外顯子組檢查并確定與PDAC易感性顯著相關的三種低頻編碼變體。在進一步的功能分析中,作者結合磷酸化iTRAQ相對定量蛋白質組學技術,首次發現rs34309238變體通過促進磷酸化PKN1的水平并激活FAK / PI3K / AKT信號傳導途徑來增加PDAC患病風險。這些發現強調了罕見編碼變體在PDAC發展中的重要性,有助于將來對該疾病的預防和治療。
解析文獻
Jiang Chang, Jianbo Tian, et al. Exome-wide analysis identifies three low-frequency missense variants associated with pancreatic cancer risk in Chinese populations[J]. Nature Communications, 2018, 9(1): 3688.
在本研究中,作者使用Illumina HumanExome Beadchip對PDAC的編碼易感基因位點進行外顯子組檢查并確定與PDAC易感性顯著相關的三種低頻編碼變體。在進一步的功能分析中,作者結合磷酸化iTRAQ相對定量蛋白質組學技術,首次發現rs34309238變體通過促進磷酸化PKN1的水平并激活FAK / PI3K / AKT信號傳導途徑來增加PDAC患病風險。這些發現強調了罕見編碼變體在PDAC發展中的重要性,有助于將來對該疾病的預防和治療。
解析文獻
Jiang Chang, Jianbo Tian, et al. Exome-wide analysis identifies three low-frequency missense variants associated with pancreatic cancer risk in Chinese populations[J]. Nature Communications, 2018, 9(1): 3688.
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










