服務介紹
雙熒光素酶檢測是轉錄調控研究中十分重要的實驗手段,主要應用于啟動子和轉錄因子,以及miRNA和其靶基因互作的驗證。
在雙熒光素酶檢測中,將螢火蟲熒光素酶作為實驗報告基因,海腎熒光素酶作為對照報告基因。實驗報告基因用于測試實驗條件下基因的表達,而對照報告基因作為內對照。
以熒光素為底物來檢測螢火蟲熒光素酶活性,熒光素酶可以催化熒光素,在熒光素氧化的過程中會發出生物熒光,然后通過化學發光儀測定。
服務優勢
- 靈敏度高:比Western blot靈敏度高1000倍以上
- 無報告基因: 植物、哺乳動物中無報告基因內源性表達
- 不受物質影響:熒光素酶檢測不受細胞內其它物質影響
- 檢測方便/范圍廣:檢測范圍廣,大于7個數量級
服務流程
客戶提供
基因模板,需提供詳細的轉錄因子、目的基因、或microRNA信息;
實驗細胞,如無特殊要求,金開瑞默認為使用293T細胞,則無需提供。
最終交付
- 實驗流程及完整報告一份,包括實驗原始數據、圖片、分析結果等。
服務說明
| 服務名稱 | 服務內容 | 交付內容及標準 | 服務周期(工作日) |
| 動物雙熒光 | 靶點基因合成 | 含400bp以下,>400bp見附加單項 | 20 |
| 質粒提取 | 返還目的基因剩余質粒 | ||
| mimics合成 | 注:僅驗證miRNA需合成mimics | ||
| 細胞轉染 | 默認做4組,每組5生物學重復 | ||
| 雙熒光素酶檢測 | 交付結題報告及原始數據 | ||
| 植物雙熒光(定量) | 質粒提取 | 返還目的基因剩余質粒 | 20 |
| 注射煙草 | 每片葉子上做4組,設5生物學重復 | ||
| 雙熒光素酶檢測 | 交付結題報告及原始數據 | ||
| 植物雙熒光(定性+定量) | 質粒提取 | 返還目的基因剩余質粒 | 20 |
| 注射煙草 | 每片葉子上做4組,設5生物學重復 | ||
| 拍攝照片 | 交付3片葉子照片 | ||
| 雙熒光素酶檢測 | 交付結題報告及原始數據 |
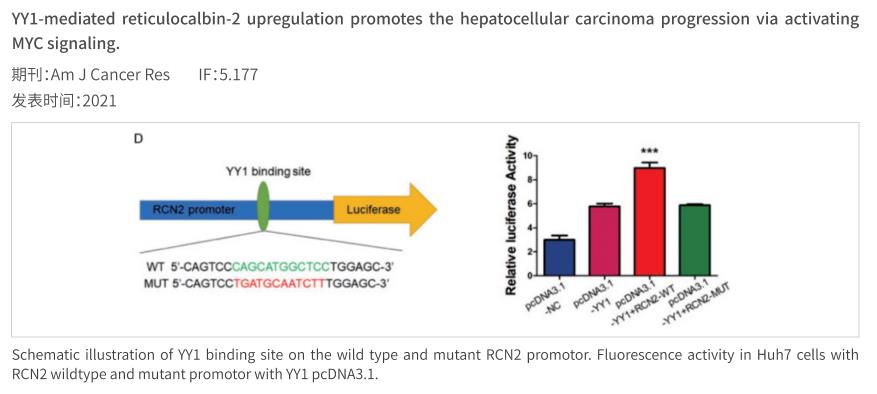
案例展示
常見問題與解析 (Q&A)
a.啟動子結構分析,將啟動子區域序列(通常2k左右)進行分段截短,或對特定位點進行突變,再分別構建入luciferase報告載體,檢測其啟動子活性。 b.啟動子SNP分析,一些基因的啟動子區域存在單核苷酸多態性,可運用熒光素酶報告系統分析其相對活性。 c.驗證特定轉錄因子同其調控序列的作用,將該序列(通常為啟動子區域)插入報告基因載體,同時在實驗細胞中共轉過表達該轉錄因子,可分析轉錄因子過表達是否提高熒光素酶活性。 d.可以分析信號通路是否激活,將該信號通路的下游響應原件序列構建入報告基因載體,在不同上游信號條件下,熒光素酶活性代表了通路的下游響應。例如在GPCR研究中,將cAMP response element(CRE)載入報告基因載體,構建穩定表達細胞株后,可以用于分析GPRC的激活與抑制劑篩選。又如,將HIF1α的響應原件hypoxia-responsive element (HRE)插入luciferase報告載體構建穩轉細胞株,可以用于低氧相關通路的研究。 e.驗證microRNA的靶序列,將待測的3’UTR序列插入報告基因載體,再共轉入該microRNA,如果熒光素酶活性下降,則提示為其靶序列。
Luciferase的靈敏度相比于GFP提高10-100倍以上,同時具有更寬的動態范圍,便于數值分析比較,不需要熒光顯微鏡,而且在活體實驗中其熒光穿透性高于EGFP等熒光蛋白,同時由于沒有內源活性、其本底信號很低。 而GFP等熒光蛋白相比于熒光素酶的優勢在于可以進行失蹤定位,并且其觀測不需裂解細胞,方便進行適時觀察。
海腎熒光素酶和螢火蟲熒光素酶相比,相對活性如何? 在氧、鎂和ATP的存在下,螢火蟲熒光素酶作用于螢火蟲熒光素,而來源于海洋腔腸(Renilla reniformis)的熒光素酶在氧的存在下作用于海腎熒光素。雙報告基因技術(Dual-reporter assays),結合了螢火蟲熒光素酶測試和海腎熒光素酶測試。
轉染效率低的話可以從三個方面改善,首先要確保細胞狀態是好的,通常我們選出處于分裂期的細胞,另外陽性對照您可以選擇過表達的熒光蛋白質粒,還有就是DNA的質量尤為重要,最好是先酶切驗證。 這個實驗檢測結果很靈敏,有一定差異是正常的,通常只要確保它在一個數量級之內即可。如果差異超出這個范圍可以從兩方面改善,一是記住保持樣本的均一性,二是加樣要準確。
相關資源
1、在雙熒光素酶報告系統研究中,一些常用網站、數據庫和資源庫的簡介
● Promega(promega.com):Promega是一個提供生命科學研究相關產品和服務的公司。他們提供多種熒光素酶底物和相關試劑盒,供科研人員在雙熒光素酶報告系統實驗中使用。
● Addgene(addgene.org):Addgene是一個非營利性的生物資源庫,提供了廣泛的質粒和表達載體,包括熒光素酶相關的質粒,供研究人員用于基因轉染和表達。
● NCBI(www.ncbi.nlm.nih.gov):NCBI(美國國家生物技術信息中心)提供了包括PubMed、GenBank、Gene等在內的多個數據庫,可用于搜索和獲取與雙熒光素酶報告系統相關的文獻、基因序列和蛋白質信息。
● PubChem(pubchem.ncbi.nlm.nih.gov):PubChem是NCBI的一個化學物質數據庫,提供了大量的化合物信息和相關的生物活性數據,可以用于熒光素酶底物的篩選和選擇。
2、雙熒光素酶報告系統的實驗步驟簡介
①細胞培養和處理:
● 準備和處理目標細胞,確保其在適當的生長狀態下進行實驗。
● 維持適當的培養條件,包括培養基成分、溫度和濕度等。
②底物處理:
● 加入熒光素酶底物和葡萄糖氧化酶底物以觸發熒光發光反應。
● 優化底物濃度,確保使用濃度適當,以獲得穩定且可檢測的熒光信號。
③信號檢測:
● 使用合適的設備進行熒光或發光信號的檢測。
● 選擇適當的檢測方法,如熒光成像儀、熒光分析儀或酶標儀。
④數據分析:
● 進行相對熒光單位的定量分析,并設置負對照和正對照組。
● 使用合適的數據分析方法,評估實驗結果的特異性和可靠性。
⑤實驗重復和統計顯著性:
● 進行足夠的實驗重復以確保結果的可靠性。
● 根據需要進行統計學分析,以評估數據的顯著性和可靠性。
⑥實驗條件控制:
● 保持實驗條件的一致性,包括細胞培養條件、培養基配制、底物制備等。
● 嚴格控制實驗的時間點和溫度,確保實驗操作在合適的時間窗口內進行。
⑦數據報告和結果解釋:
● 撰寫實驗報告或論文,清晰地呈現數據和結果。
● 結合相關背景知識和文獻,解釋實驗結果的意義和可能的機制。
3、除了雙熒光素酶報告系統實驗,還有哪些常用于研究基因表達調控和信號通路活性的實驗方法?
① 免疫沉淀(Immunoprecipitation,IP):
? 使用特異性抗體將目標蛋白與其相互作用的分子(如蛋白質復合物或DNA序列)結合,并通過沉淀、洗滌和分析來鑒定和定量這些相互作用。
② 染色質免疫沉淀(ChIP,ChIP-seq):
? 利用特異性抗體將某個蛋白質與染色質中的靶標位點結合,并通過免疫沉淀和測序技術,鑒定和分析該蛋白質在基因組上的結合位點及其調控作用。
③ 蛋白質互作分析:
? 利用蛋白質交聯、共沉淀和質譜分析等技術,鑒定和分析蛋白質之間的相互作用關系,從而揭示基因表達調控和信號通路中的蛋白質網絡。
④ 基因組學和轉錄組學分析:
? 利用高通量測序技術,如RNA-seq、ChIP-seq和ATAC-seq等,全面分析基因表達、染色質狀態和轉錄因子結合位點,揭示基因調控網絡和信號通路的動態變化。














