酵母單雜交
- 酵母單雜
- 高通量篩選
- 假陽性率低
服務特色
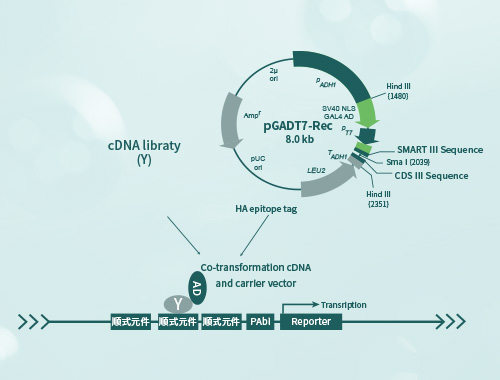
酵母單雜交(Yeast One-Hybrid)是一種用于研究蛋白質與DNA序列之間相互作用的實驗技術。它結合了酵母細胞內的轉錄激活和檢測系統,用于篩選和鑒定與給定DNA序列相互作用的蛋白質,具有高通量篩選、生理相關性、較低的假陽性率、定量分析能力以及適用于多個研究領域的優勢。
服務介紹
酵母單雜交技術是在酵母雙雜基礎上發展而來的一種研究核酸-蛋白相互作用的工具,被廣泛用于研究真核細胞內基因的表達調控,如鑒別DNA結合位點發現潛在的結合蛋白基因、分析DNA結合結構域信息等。
服務優勢
- 一站式輔助檢測手段方便快捷,得到可靠的實驗結論;
- 多年文庫構建經驗,4種優化的Total RNA提取技術方案可以有效保證Total RNA的純度和完整性,保證樣本的多樣性;
- 可同時研究多個蛋白質相互作用,實現高通量篩選和分析,快速獲得大量相互作用信息;
- 采用多個篩選步驟,如報告基因的驗證和雙重選擇,減少非特異性相互作用的誤報。
客戶提供
1、物種信息,樣本類型
2、基因序列信息
3、實驗目的
最終交付
- 文庫菌液,文庫質粒
- 高通量蛋白質組學分析(GO及KEGG功能注釋)
- 原始數據及結果圖片
服務說明
服務流程
酵母單雜交文庫篩選
酵?雜交?庫構建:
酵母雜交驗證:
其他流程
| 服務項目 |
客戶提供 |
最終交付 |
| 文庫構建 | 組織/細胞 |
滴度在1×10°cfu/mL以上的酵母文庫菌液;文庫PCR鑒定結果圖片(陽性率在90%以上) |
| 文庫篩選 |
promoter基因序列/質粒 |
篩選過程中的全部原始圖片;篩選獲得所有相互作用的獵物蛋白的測序結果 |
針對酵母單雜交實驗結果,可作進一步驗證:
| 服務內容 |
實驗目的 |
細分 | 周期(工作日) |
| EMSA | 驗證啟動子和蛋白互作 |
探針合成及標記 |
10 |
|
EMSA實驗 |
20 | ||
| 雙熒光素酶檢測 | 驗證啟動子和蛋白互作 | 10-15 | |
| 25 |
案例展示

相關技術服務
| ? 雙熒光素酶報告系統 | ? EMSA | ? CO-IP |
| ? RNA pull-down | ? RIP-qPCR | ? DNA pull-down |
| ? ChIP-qPCR | ? 酵母雙雜交 | ? CUT&Tag |
相關資源
一、酵母單雜交技術具體的應用領域:
● 轉錄因子研究:酵母單雜交可用于研究轉錄因子與DNA序列的特異性結合。通過構建誘餌包含啟動子或增強子序列,并與獵物中的轉錄因子相互作用,可以鑒定和驗證轉錄因子-基因調控序列的相互作用關系。
● DNA結合蛋白鑒定:酵母單雜交可用于鑒定與特定DNA序列相互作用的蛋白質。通過構建誘餌包含DNA結合序列,與獵物中的蛋白質相互作用,可以篩選和驗證與該DNA序列特異性結合的蛋白質。
● 蛋白質相互作用網絡:通過酵母單雜交技術可以篩選和鑒定蛋白質間的相互作用關系,從而構建蛋白質相互作用網絡。這有助于了解細胞內蛋白質相互作用的調控機制、信號傳導途徑和細胞過程的調節。
● 疾病相關蛋白質研究:酵母單雜交可用于研究與疾病相關的蛋白質相互作用。通過構建誘餌包含疾病相關基因的序列,與獵物中的蛋白質相互作用,可以鑒定潛在的疾病相關蛋白質相互作用伙伴。
● 藥物篩選和靶點鑒定:酵母單雜交可用于篩選和鑒定與小分子化合物相互作用的蛋白質。通過將小分子化合物作為誘餌,與獵物中的蛋白質相互作用,可以評估潛在藥物的靶點和相互作用機制。
二、當酵母單雜交技術與其他實驗方法結合使用時,可以提供更全面和深入的研究結果。以下是一些常見的與酵母單雜交技術聯用的實驗方法和其應用舉例:
● 免疫共沉淀(Co-Immunoprecipitation,Co-IP):通過與酵母單雜交技術聯用,可以驗證蛋白質相互作用的存在并進一步分析相互作用的性質。例如,在酵母單雜交實驗中篩選出與誘餌相互作用的獵物后,可以使用Co-IP方法來驗證這些相互作用是否發生在真實的細胞環境中。
● 質譜分析(Mass Spectrometry,MS):與酵母單雜交聯用的質譜分析可用于鑒定與誘餌相互作用的蛋白質。通過將與誘餌相互作用的蛋白質從酵母細胞中純化并用質譜分析鑒定,可以確定相互作用蛋白的身份。
● 染色質免疫沉淀(Chromatin Immunoprecipitation,ChIP):酵母單雜交結合ChIP技術可以用于研究轉錄因子與DNA的相互作用,并確定特定DNA區域的轉錄因子結合位點。通過將轉錄因子與GST融合,并使用酵母單雜交篩選出與GST-融合轉錄因子相互作用的蛋白質,然后使用ChIP技術來鑒定這些蛋白質在基因組上的結合位點。
● 熒光共振能量轉移(Fluorescence Resonance Energy Transfer,FRET):酵母單雜交與FRET技術聯用可以用于直接檢測蛋白質-蛋白質相互作用的發生。通過將誘餌和獵物蛋白質分別標記為供體和受體熒光染料,當兩者相互作用時,可以通過FRET信號的變化來確認相互作用的發生。
● 三維染色質構象分析:酵母單雜交技術與染色質構象分析方法(如3C、4C、5C、Hi-C等)聯用,可以研究蛋白質與染色質之間的相互作用對染色質三維結構的影響。通過將與特定染色質區域相互作用的蛋白質進行酵母單雜交篩選,然后使用染色質構象分析方法來探索蛋白質與染色質之間的聯系。
三、常見問題與解析
1、什么是均一化和三框文庫,對文庫質量有什么影響?金開瑞對三框文庫是如何處理的?
? 均一化cDNA文庫:是指某一特定組織或細胞的所有表達基因均包含其中,且在cDNA文庫中表達基因對應的cDNA的拷貝數相等或接近。減少冗余轉錄物的拷貝而增加低豐度轉錄物的拷貝而構建的cDNA文庫。簡單說就是降低高峰度的核酸,這樣低峰度核酸就會占比高一些。均一化cDNA文庫是克服基因轉錄水平上巨大差異給文庫的篩選和分析帶來障礙的有效措施,有利于研究基因的表達和分析。現在,在構建均一化cDNA文庫中至少有兩種主要的觀點。一種是基于復性動力學的原理,高豐度的cDNA在退火下復性速度快,而低豐度的cDNA復性要很長時間,從而可以通過控制復性時間來降低豐度;另一種是基于基因組DNA在拷貝數上具有相對均一化的性質,通過cDNA和DNA的飽和雜交而降低在文庫中高拷貝存在的cDNA的豐度。
? 三框文庫:氨基酸對應三個密碼子,文庫中CDNA的片段大小是隨機的,讀碼框也是隨機的,例如ATG,有可能是從A開始翻譯,也有可能是從T或G開始翻譯,這種情況下就只會出現一個正確的讀碼,如果客戶感興趣的基因恰好移碼了,這樣就會提前終止,篩選也不可能被篩出來。三框通過人為的引入一個和兩個堿基,使每個移碼的基因都能正確的被讀出來。
? 金開瑞三框文庫:傳統的三框文庫均是通過引物的方式人為引入突變的,金開瑞采用載體改造的方式在載體上引入三個不同的讀碼框突變。這樣的三框文庫構建只用合成一份雙鏈cDNA,cDNA的合成純化均是在同樣的反應條件下進行的,可以完全保證三框文庫的片段長度,文庫滴度等信息的完全一致性,減少三框文庫的差異對篩選結果的影響。
2、如果誘餌可以直接激活報告基因,該如何處理?
為保證誘餌蛋白功能的完整性,首先我們會考慮用3'AT/ABA進行背景抑制,但是由于這兩種試劑對酵母生長具有較大的毒性,后續可能會影響文庫篩選,因此在3'AT超過15mM,ABA超過1200ng/ml時我們會考慮將誘餌蛋白進行截斷,通過查閱文獻和相關數據庫,截去轉錄激活的區域,需要注意的是,截去的這一部分很有可能會影響到互作結果。
3、酵母誘餌該選擇全長還是核心區域?
(1)全長:
優點:更接近于自然條件下的環境;
缺點:有時候過于長,導致構建具有一定的難度,更可能的產生自激活現象。
(2)預測的核心元件(<20bp):
優點:核心元件用于后續的EMSA驗證試驗,對核心位點進行突變驗證啟動效果是否減弱,相對全長啟動子而言突變的區域較少操作更為方便;
缺點:核心元件雖然是啟動的核心區域,但是啟動子的其他區域也可能是作為輔助元件而存在的,如果缺少這些部分就是非自然條件下的環境,可能產生假陰性。
(3)蛋白結構功能域:
優點:能準確的研究出這部分區域是否在全長中行使重要的功能,為同一類型的功能研究具有重要的意義;
缺點:不確定其他功能域是否與它一起行使其他功能,或者需要二者之間的搭配才能行使某一項功能,可能會產生假陰性。
4、酵母雜交發生假陽性的原因及解決方式
產生原因:
(1)由于BD融合誘餌蛋白有單獨激活作用,或者其激活作用被外來蛋白激活。
(2)AD融合靶蛋白如果有DNA的特異性結合,也可以單獨激活報告基因的表達。
(3)BD和AD在文庫中會有隨機碰撞導致空間上的接近,以致下游報告基因的表達。
解決方法:
(1)對于點對點驗證來說,可同時將誘餌和獵物進行自激活驗證,減少假陽性的判定,但是一旦誘餌和獵物均產生自激活,后續自激活的處理方式(截短)會浪費較多的時間;(我們一般不采取這種解決方式)
(2)由于每個報告基因上游的調控區各不相同,因此用不同的報告基因驗證陽性,可用于排除或減少假陽性;(我們主要采用這種解決方式)
(3)單雜啟動子,我們主要采用將報告基因整合到酵母的染色體上,可以使基因表達水平文檔,消除了由于質粒拷貝數變化引起的基因表達水平的波動而造成的假陽性。











