一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”
“電泳遷移率變動分析法”或“凝膠遷移實驗”(Electrophoretic Mobility Shift Assay, EMSA)是一種用于研究蛋白質-DNA或蛋白質-RNA相互作用的技術。通過EMSA,研究人員可以檢測特定蛋白質是否能夠特異性地結合到DNA或RNA序列上,從而揭示基因表達調控中的關鍵機制。EMSA技術廣泛應用于生物學和醫學研究領域,特別是在基因表達調控、疾病機理研究以及藥物靶點發現等方面。
實驗原理
EMSA是用核酸探針和樣本蛋白混合孵育,樣本中的核酸-蛋白質復合物在聚丙烯酰胺凝膠的遷移速度會慢于游離的探針并形成一條滯后帶,根據凝膠上滯后帶的有無和多少來定量DNA結合蛋白的有無和結合活性。EMSA是一種簡單、快速、可定性與定量的體外蛋白質與DNA相互作用檢測方法,且適用于未經純化的蛋白與純化的重組蛋白。
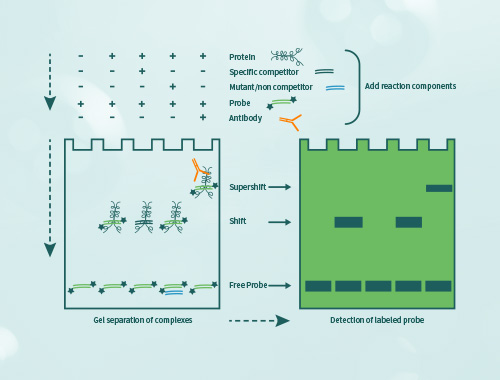
實驗步驟
EMSA技術的操作流程主要包括以下幾個步驟:
●根據研究目的設計特異性探針實驗組以及非特異性對照組;
●將設計好的探針與樣本蛋白混合孵育,形成蛋白-探針復合物;
●進行聚丙烯酰胺凝膠電泳,并將蛋白-探針復合物轉移到膜上;
●在膜上檢測、曝光成像,觀察蛋白-探針復合物的位置,從而判斷是否有蛋白與目標探針有互作。
案例展示及結果解析
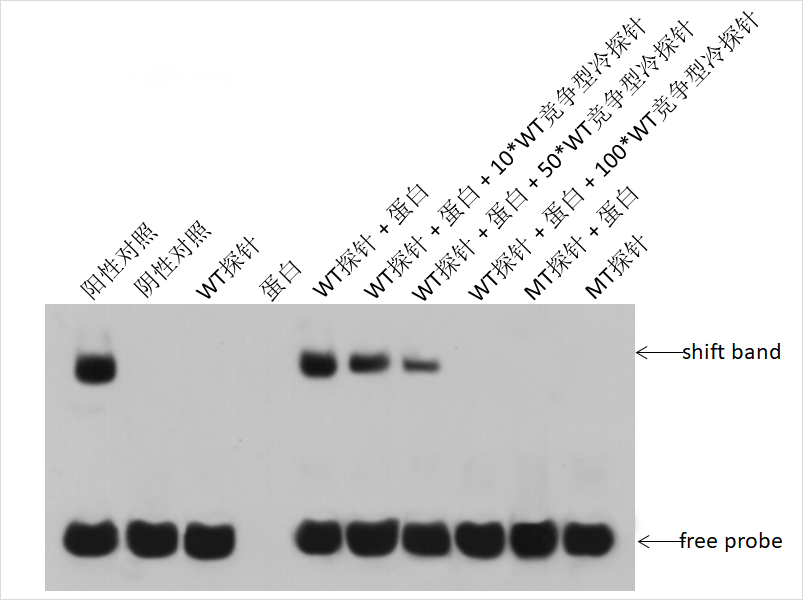
●EMSA實驗檢測的是生物素信號,即生物素標記的探針,因此通常最下方會出現一列探針條帶;
●在同時加入蛋白與WT探針,且兩者可以結合的情況下,探針由于結合了蛋白,電泳速率下降,因此會在上方出現遷移條帶;
●競爭型冷探針是序列與WT探針一致但沒有生物素標記的探針,因此雖然其也能與蛋白結合,但無法被檢測到,因此隨著競爭型探針上樣量增多,遷移條帶會變淺或消失;
●MT探針是結合位點序列突變后的WT探針,由于無法再與蛋白結合,所以沒有出現遷移條帶;有時突變后也會出現遷移條帶,說明突變的序列不對,或突變不完全,需要重新設計突變探針;
●有時泳道中不僅會加入蛋白與WT探針,還會額外加入能夠結合蛋白的抗體,由于遷移速率進一步被影響,會在常規遷移條帶上方再出現另一條遷移條帶,稱為“超遷移”。
常見問題分析
盡管EMSA是一種強大的實驗工具,但在實際操作過程中也存在一些常見問題,如非特異性結合、信號背景過強就讓不少科研同胞頭疼不已,下面我們一起來看看它們是什么原因造成的,方便大家逐一排查,各個擊破。
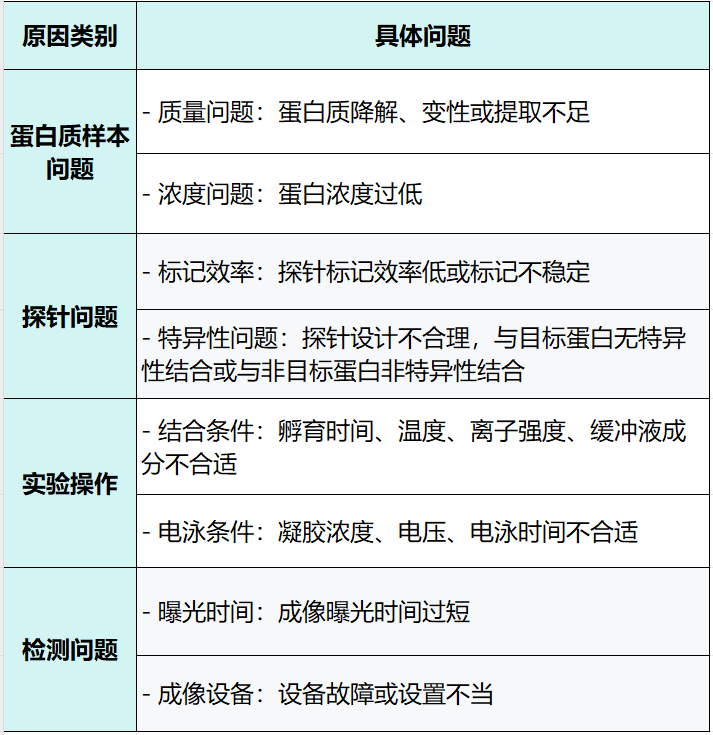
1.看不到遷移帶是什么原因?
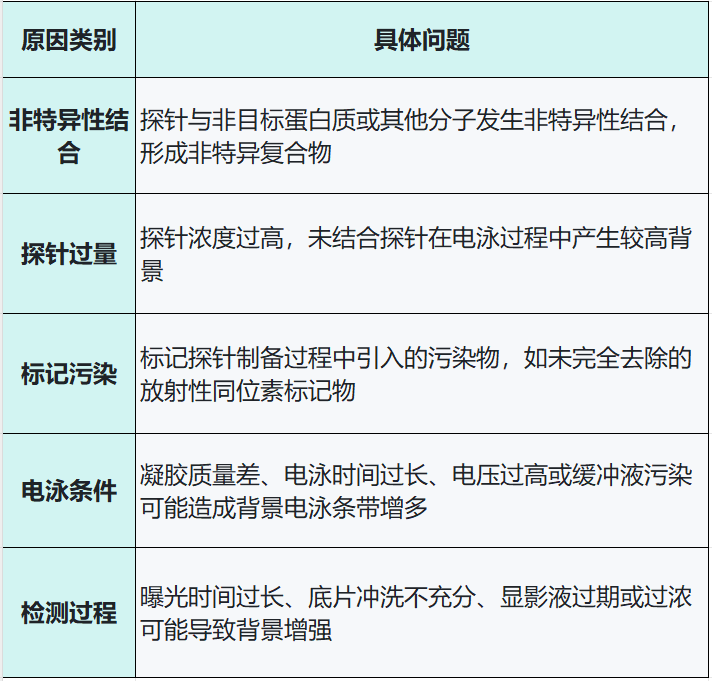
2.實驗背景高的原因分析
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










