【文獻解讀】IF=6.38,完整N-糖肽定性和定量分析探究巖藻糖化修飾對前列腺癌侵襲轉移的作用機制
信息來源:金開瑞 作者:genecreate 發布時間:2020-06-01 16:13:14
題目:Site-Specific Fucosylation Analysis Identifying Glycoproteins Associated with Aggressive Prostate Cancer Cell Lines Using Tandem Affinity Enrichments of Intact Glycopeptides Followed by Mass Spectrometry
期刊:Anal Chem
影響因子:6.38
主要技術:完整N-糖肽定性和定量分析
研究背景
蛋白質的糖基化是重要功能蛋白質修飾之一,在多種細胞過程中起著至關重要的作用,例如細胞粘附,受體活化,腫瘤浸潤,轉移和炎癥反應。1-4巖藻糖基化(Fuc),尤其是核心Fuc分支是最常見的基于糖基化的修飾之一,據報道與癌癥和炎癥等疾病的發展有關。研究表明,正常、良性腫瘤、癌癥以及其他疾病生物學樣品中的Fuc含量不同。核心Fuc糖蛋白已被用作臨床診斷中的生物標志物,α胎蛋白的核心Fuc糖型(AFP-L3)已獲得FDA批準作為肝細胞癌的診斷性生物標志物。
在這項研究中,作者開發一種方法,富集完整的Fuc糖肽來分析Pca細胞中糖基特異性巖藻糖基化修飾,用于評估各種Fuc結合凝集素的特異性,探究巖藻糖化修飾對前列腺癌侵襲轉移的作用機制,為新的標志物發現和治療指出新的方向。
實驗思路
實驗結果
01Fuc糖肽的富集策略評估
凝集素對糖鏈有很好的富集作用,但當凝集素單獨用于富集復雜樣品中的糖肽時,可能會發生非特異性結合。Oasis MAX是一種基于親水性的強陰離子交換色譜柱,具有很高的效率。為了評估和確定Fuc糖肽的最佳富集策略,作者分別以六種凝集素(LCA,PSA,AAL,LTL,UEA I和AOL)及六種凝集素串聯Oasis MAX親和柱進行檢測。以比較不同富集方法對巖藻糖糖肽的富集效率。
與單獨使用Oasis MAX富集相比,凝集素富集可以提高已鑒定的Fuc糖肽與總糖肽的比率(圖1a)。此外,盡管某些凝集素中Fuc糖肽的比例略有下降,但凝集素—Oasis MAX的富集可顯著增加已鑒定的完整糖肽的數量(圖1b)。根據這些結果,我們得出結論,在富集Fuc糖肽時,先用凝集素,然后用MAX進行串聯富集比單獨使用MAX和單獨使用凝集素更好。
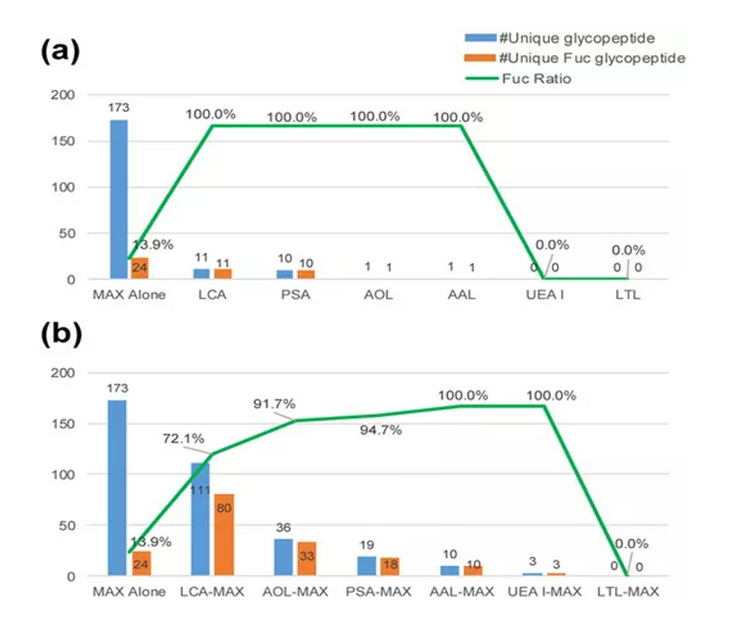
圖1不同富集策略鑒定結果
02完整Fuc糖肽凝集素親和富集的特異性
隨后,作者分析了巖藻糖在糖鏈中的位置,核心Fuc和支鏈Fuc的特征離子用于研究凝集素-Oasis MAX樣品中凝集素對核心或支鏈Fuc的特異性。通過對核心和支鏈Fuc的代表性光譜以及被不同凝集素富集的每個特征離子的Fuc聚糖的數量分析,結果表明,LCA和PSA優先與核心Fuc結合,而AOL,AAL和UEA I對Fuc聚糖表現出廣泛的特異性。
接下來,作者考慮了對核心Fuc的結合能力和特異性,分析了使用LCA-MAX,PSA-MAX,AOL-MAX和MAX單獨富集的已鑒定Fuc聚糖的數量(圖2-d)。結果也表明LCA和PSA對核心Fuc具有相似的特異性。
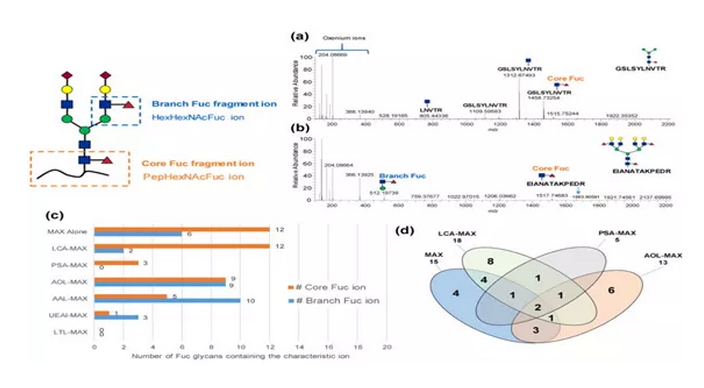
圖2 Fuc糖肽的凝集素特異性結果
03通過LCA-MAX對Pca細胞的Fuc糖肽進行大規模分析
根據上述結果,我們選擇LCA-MAX串聯富集的方法,對四種Pca細胞系中的核心Fuc糖蛋白組進行富集,隨后進行TMT標記,以定量分析來自四個不同細胞系的Fuc糖肽。
從四個Pca細胞系中鑒定了252個獨特Fuc蛋白,973個獨特的完整Fuc糖肽(參見圖4a)。并對同一糖肽上巖藻糖修飾的個數進行了分析,發現大多數Fuc糖肽上只有一個巖藻糖化修飾。
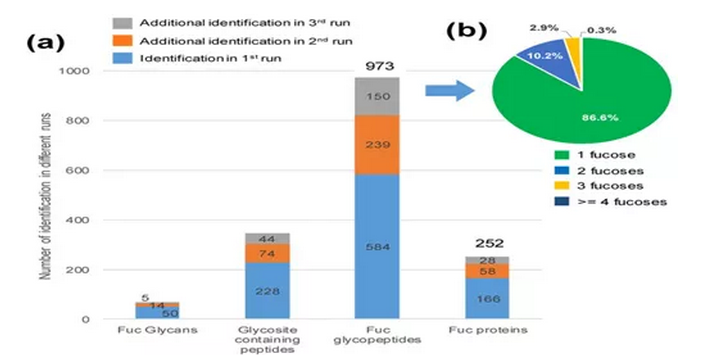
圖3 從四個Pca細胞系大規模分析Fuc糖蛋白組的結果
04侵襲性(AG)和非侵襲性(NAG)Pca細胞系中差異表達的Fuc糖肽
接著,研究者使用TMT報告標簽計算在不同樣品(細胞系)中鑒定出的Fuc糖肽的比例,從26種Fuc蛋白中鑒定出51種Fuc糖肽,發現它們與NAG細胞系相比在AG中表達上調。為了深入了解這些差異表達的Fuc蛋白的生物學影響,我們對我們的結果進行了(KEGG)Mapper途徑分析。KEGG分析顯示,這些蛋白質與ECM-受體相互作用,PI3K-AKT信號傳導途徑和粘著斑的途徑有關。通過ECM-受體相互作用途徑,AG細胞系中來自整合素α-2(α2),整合素α-3(α3)和整合素β-1(β1)的13個Fuc糖肽被上調。
整合素蛋白是促進細胞-細胞外基質(ECM)粘附的跨膜受體,其巖藻糖化修飾增加,能促進腫瘤細胞遷移;表皮生長因子受體(EGFR)已被證明在包括前列腺癌在內的多種癌癥的轉移中起關鍵作用,與NAG細胞相比,在AG細胞中被高度巖藻糖基化;最后,我們鑒定了三種源自天冬氨酰/天冬酰胺基β-羥化酶(HAAH)的過表達Fuc糖肽,其中之一在AG和NAG之間有明顯差異。這些結果共同表明,巖藻糖化修飾增加在肝癌侵襲活性中起著重要的功能作用。
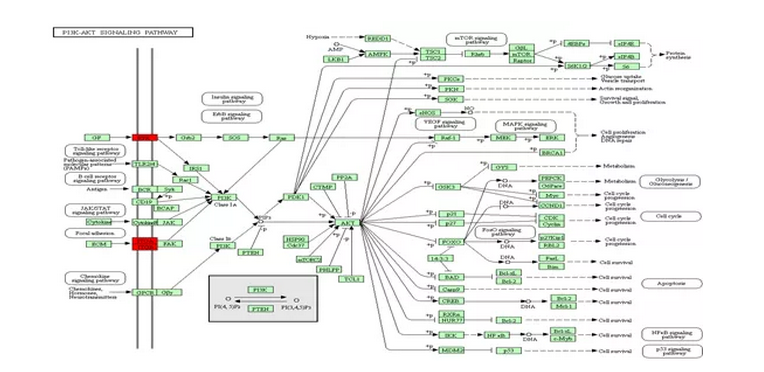
圖4 KEGG信號通路分析
總結與討論
在這項研究中,我們建立了選擇性富集核心Fuc糖肽的策略,并評估了NAG和AG Pca細胞系之間巖藻糖基化分布的變化。我們首先說明了串聯凝集素和MAX柱對Fuc糖肽的富集是最佳的。接下來,我們探索了與巖藻糖結合的凝集素的特異性,顯示LCA,PSA和AOL的結合能力強于AAL,LTL和UEAI。此外,LCA和PSA特異性結合了核心Fuc,而AOL,AAL和UEA對Fuc聚糖表現出廣泛的特異性。在這些凝集素中,LCA是富集核心Fuc糖肽的最佳凝集素,并在我們的串聯富集策略中用于描述NAG和AG Pca細胞系的Fuc糖蛋白組。我們的研究不僅確定了Fuc結合凝集素的特異性,而且建立了串聯Fuc糖肽富集的工作流程,闡述了巖藻糖化修飾對前列腺癌侵襲轉移的作用機制,為新的藥物研發和腫瘤標志物的篩選提供了新的思路。
金開瑞糖基化修飾鑒定
糖基化是在酶的控制下在蛋白質或脂質上附加糖類的過程,起始于內質網,結束于高爾基體。在糖基轉移酶作用下將糖轉移至蛋白質,和蛋白質上的氨基酸殘基形成糖苷鍵,并在糖基轉移酶和糖苷酶的剪切、加工下形成各種類型的糖鏈。
糖基化蛋白質組學的核心任務是利用組學的手段,從全局上去尋找發生糖基化修飾的位點,解析糖鏈的結構,鑒定完整的糖肽,探索糖蛋白在生命活動中扮演的角色和生物學功能。
基于GPSeeker軟件的-糖基化修飾鑒定
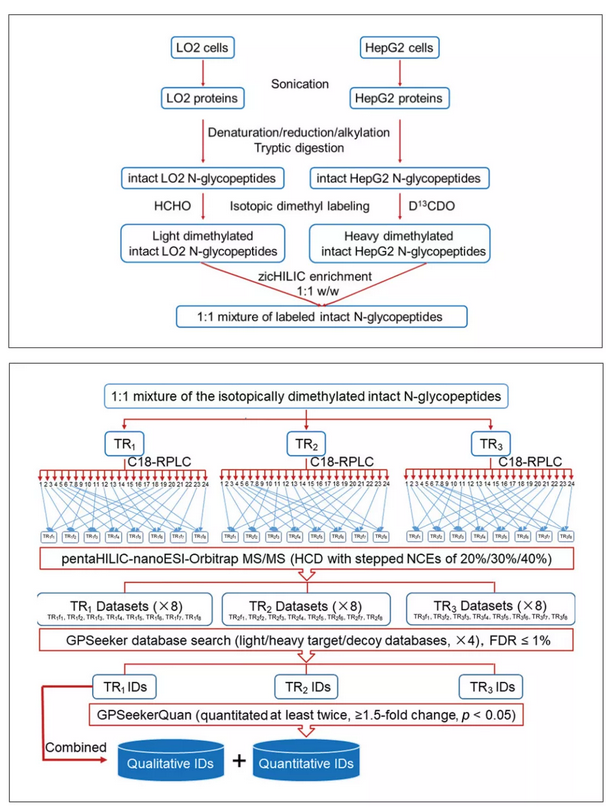
(圖片引自Site- and Structure-Specifific QuantitativeN-Glycoproteomics UsingRPLC-pentaHILIC Separationand the Intact N-Glycopeptide SearchEngine GPSeeker)
優勢小結
基于GPSeeker軟件的-糖基化修飾鑒定
1、除了能夠確定蛋白發生糖基化修飾的位點外,還能依賴開發的”GPSeeker”搜庫軟件對該位點發生糖基化修飾的糖鏈結構進行分析;
2、能知道發生糖基化修飾位點上的完整糖鏈信息;
3、基于完整N-糖肽液-質聯用分析特征所發展穩定同位素標記可實現疾病差異表達糖基化的相對和絕對定量。
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










