Cell Reports:利用空間轉錄組解析哺乳動物精子生成
組織細胞的空間關系對細胞發育、分化有重要影響。Slide-seq是一種基于原位捕獲的高通量空間轉錄組技術,特點是無偏向性、10μm分辨率,其開發者陳飛團隊以“Dissecting mammalian spermatogenesis using spatial transcriptomics”為題于2021年11月發表在Cell Reports上,利用空間轉錄組圖譜解析精子發生的表達動力學以及糖尿病對精子生成的影響。
精子發生是精子產生的生物學過程,精子生成于睪丸的曲細精管。曲細精管總共約占睪丸總體積的 60% ~ 80%,它含有生精細胞、管周細胞和支持細胞。精子發生過程起始于精原干細胞的分化,終止于成熟的精子形成。不同的精原干細胞在曲細精管中按照特殊的細胞聯系排列,形成所謂的精子發生過程。高通量單細胞RNA測序(scRNA-seq)可以捕獲生殖細胞在每個發育階段的基因表達譜的異質性,然而scRNA-seq會丟失細胞所處的空間環境,未能捕捉到生殖細胞譜系和體細胞譜系之間的空間相互作用阻礙了對精子發生的全面了解。利用Slide-seq數據,作者設計了一個計算框架,可以精確地定位單個曲細精管中的睪丸細胞類型,無偏向性地系統識別具有空間模式的基因和基因程序。結合Slide-seq和靶向原位RNA測序,作者利用空間轉錄組圖譜解析精子發生的表達動力學,證明了小鼠和人類睪丸中精原細胞微環境的細胞組成存在顯著差異。最后,對野生型和糖尿病小鼠睪丸的空間圖譜進行比較,發現曲細精管的空間細胞組織破壞是糖尿病誘導雄性不育的潛在機制。
1. 繪制小鼠睪丸的空間細胞圖譜
作者建立了一個工作流程以將睪丸mRNA捕獲到Slide-seq陣列上(圖 1A和1B)。每個陣列由具有獨特空間條形碼的直徑10 μm珠子組成,對這些條形碼進行原位測序,以將每個珠子對應到一個獨特的空間位置(圖 1A)。接下來,在冷凍切片期間,將冷凍睪丸薄切片(厚約10 μm)放置在空間索引珠陣列的頂部,并且讓珠子捕獲來自睪丸切片的mRNA。來自條形碼庫的后續測序數據可以唯一匹配到珠陣列上的空間坐標(圖 1B)。Slide-seq陣列直徑 (3 mm) 可以完全覆蓋成年小鼠睪丸橫截面。通過此工作流程,可以通常獲得較高mRNA捕獲率,平均每個珠子捕獲784±25個轉錄本(特異分子標識符UMIs),每個陣列的平均珠數29333±1514個。
在識別細胞類型之后,作者將曲細精管的信息和生精上皮周期的不同階段分配給每個珠子。為此,作者首先進行了擬時序分析,以沿著轉錄軌跡排列每個珠子。該分析概括了已知的生殖細胞發育軌跡(圖 1E)。接下來,作者開發一個計算流程來對屬于同一曲細精管的Slide-Seq珠進行自動分組(圖1F),并基于擬時序分析來重建曲細精管圖像,保留了橫截面的形態細節。最后,一個生精周期可以分為幾個亞階段,每個階段都包含不同的生殖細胞亞型關聯。通過將具有已知階段依賴性表達模式(例如Prm1)的基因表達譜投影到曲細精管的 UMAP(統一流形近似和投影)上(圖 1G),將每個精管分配給四個主要階段簇(階段 I-III、IV-VI、VII-VIII 和 IX-XII)之一(圖 1H)。
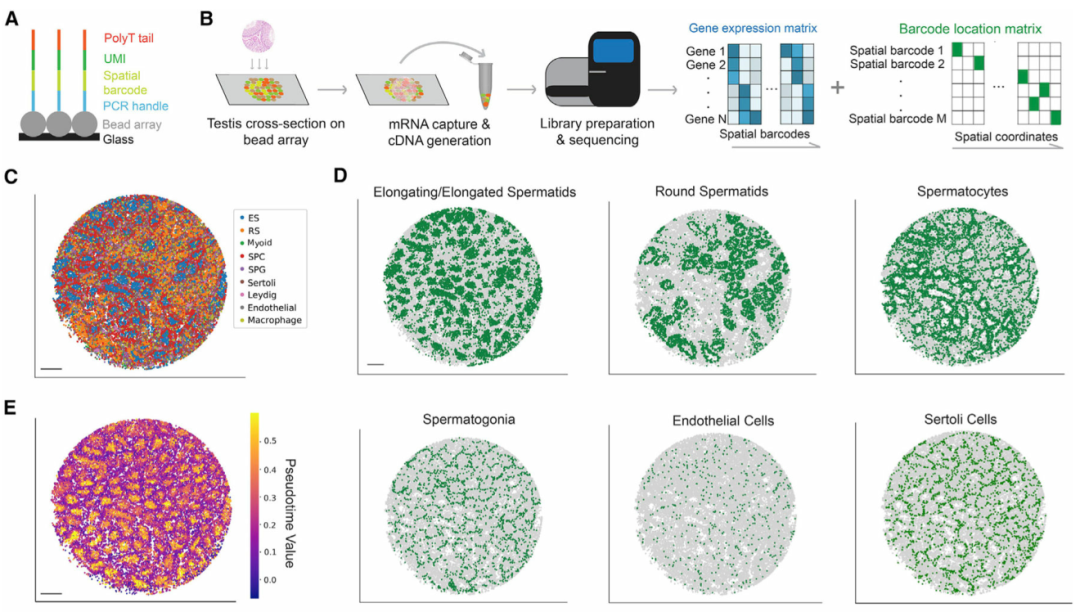
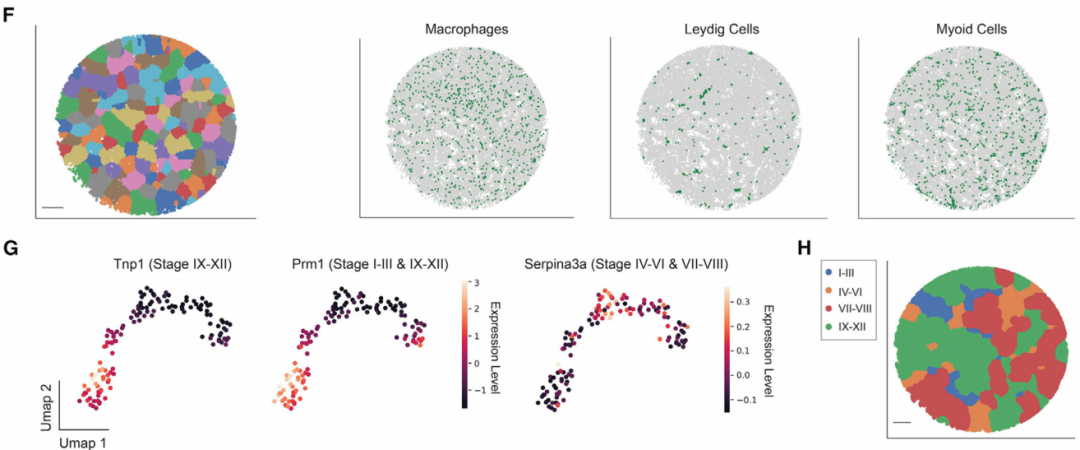
圖 1 繪制小鼠睪丸空間轉錄組圖譜,本文圖片引用自Chen et al., 2021
(A) Slide-seq微珠寡核苷酸序列示意圖。
(B) 睪丸樣本的Slide-seq工作流程。
(C) 睪丸細胞類型的空間映射。ES,伸長中/伸長的精細胞;RS,圓形精子細胞;SPC,精母細胞;SPG,精原細胞。比例尺,300 μm。
(D) 單個睪丸細胞類型的空間映射。比例尺,300 μm。
(E) 生殖細胞發育軌跡的擬時序重建。比例尺,300 μm。
(F) 曲細精管的數字分割。比例尺,300 μm。
(G) 曲細精管在基因表達空間中的UMAP投影。細胞簇根據已知階段特異性表達模式基因的表達量來著色。
(H) 四個階段集群的空間映射。比例尺,300 μm。
2. 曲細精管中 SP 基因的系統鑒定
具有空間非隨機分布的基因可能在不同的細胞類型或細胞亞型中發揮作用。為此,作者使用空間轉錄組圖譜在單個曲細精管水平鑒定空間非隨機分布的基因(以下稱為SP基因)(圖 2A)。在所有SP基因中,57.9% (589)是先前鑒定的廣泛出現在多種類型細胞的基因。作者使用單分子熒光原位雜交(smFISH)證實了SP基因鑒定的準確性(圖 2B)。接下來,作者對已識別的SP基因進行了基因本體(GO)富集分析。盡管精子細胞發育和分化等信號通路在所有階段共享,但作者發現某些信號通路是階段富集的(圖 2D)。作者通過觀察精細胞在精子發生過程中的基因表達譜,并根據它們所屬的階段對它們進行排序(圖 2E)。作者根據各個階段細胞的空間轉錄組數據進行排序,概括出精子發生過程中組蛋白到精蛋白轉變的時間動態。
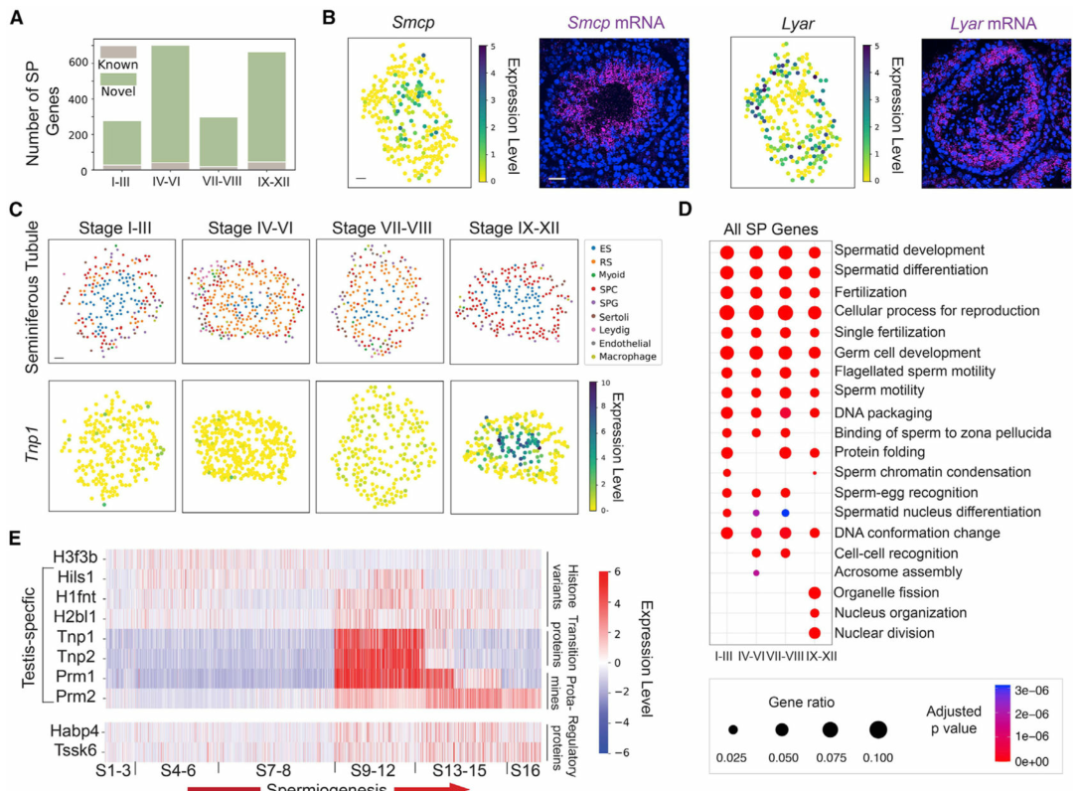
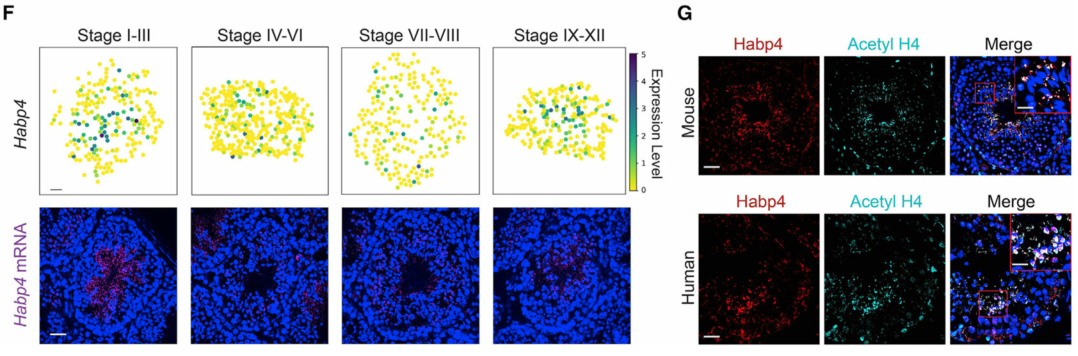
圖 2 曲細精管空間非隨機分布(SP)基因的系統鑒定
(A) 在生精上皮循環的每個階段,具有先前已知空間模式的基因數量與使用空間轉錄組圖譜新鑒定的基因數量。
(B)空間轉錄組圖譜和單分子熒光原位雜交 (smFISH)揭示了Smcp和Lyar的空間表達模式。比例尺代表 30 μm 的數字重建曲細精管圖像和 50 μm 的 smFISH 圖像。
(C) 空間轉錄組圖譜揭示了Tnp1的階段依賴性空間表達模式。ES,伸長中/伸長的精細胞;RS,圓形精子細胞;SPC,精母細胞;SPG,精原細胞。
(D)四個階段簇的SP基因的基因本體(GO)富集分析。
(E) 精子發生過程中核組織中富集的 SP 基因的時間表達動態。
(F) 空間轉錄組圖譜和 smFISH 揭示了Habp4的階段依賴性空間表達模式。
(G) Habp4 蛋白與乙酰化組蛋白 4 (Acetyl H4) 在小鼠和人類精子細胞中的共定位。比例尺代表鼠標圖像的 40 μm 和插圖的 10 μm。比例尺,人類圖像為40 μm ,插圖為15 μm。
3. 識別間質細胞和巨噬細胞的階段特異性表達模式
作者接下來轉向在不同睪丸細胞類型中具有階段特異性表達模式的基因。階段特異性基因表達已被證明是睪丸中生殖細胞和體細胞的基本特征。然而,間質和管周空間中體細胞的階段特異性表達模式在很大程度上仍未明確。為此,作者使用空間轉錄組圖譜對間質細胞和巨噬細胞進行差異基因表達分析。作者首先在I-III、IV-VI和VII-VIII 階段簇中分別鑒定了間質細胞的階段特異性基因(圖 3A)。為了進一步驗證結果,作者使用smFISH來確認H2bl1在 IV-VI 期相關間質細胞中的階段特異性(圖 3B)。有趣的是,作者注意到表達H2bl1(也稱為1700024P04Rik)的間質細胞優先定位在管周間隙附近(圖 3B)。表達H2bl1的間質細胞的稀疏性和空間定位類似于干間質細胞,作者發現H2bl1可能參與調節間質干細胞功能。與對間質細胞的分析類似,對巨噬細胞群進行差異基因表達分析(圖 3C)。然后作者使用smFISH來確認Efcab6的階段特異性表達模式(圖 3D)。作者通過鑒定階段依賴性基因表達程序,證明了生精上皮細胞的循環如何影響間質細胞和巨噬細胞的分子組成,還根據空間定位成功區分了睪丸巨噬細胞的兩個譜系。
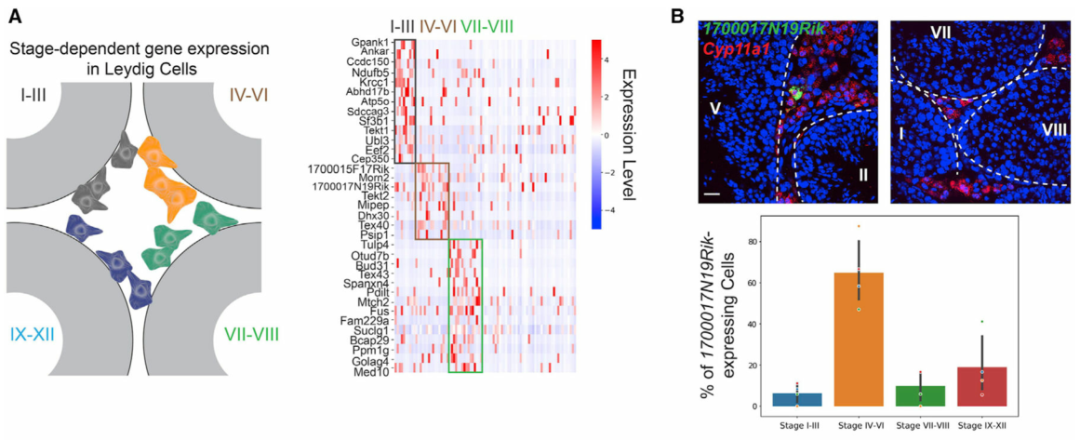
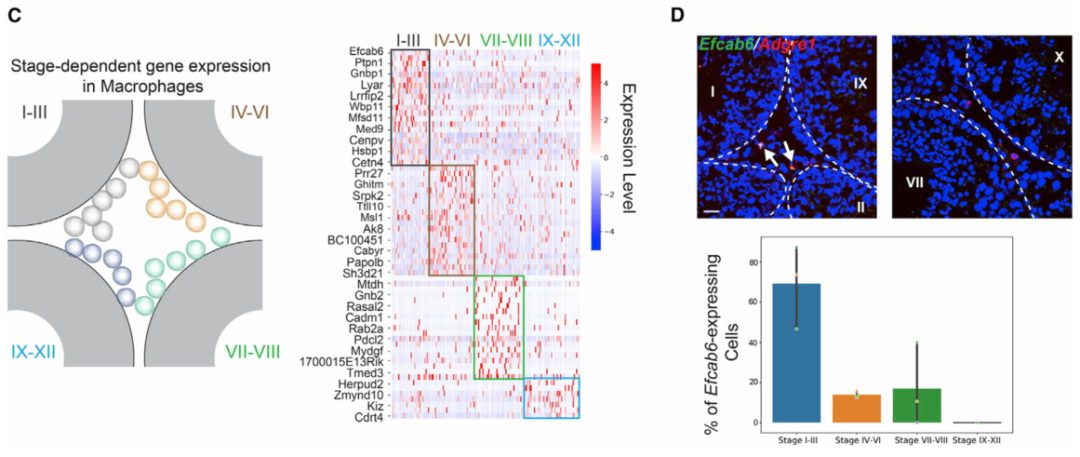
圖 3 間質細胞和巨噬細胞的階段依賴性基因表達模式
(A) 左圖:間質細胞空間定位示意圖。右圖:在間質細胞中表現出階段依賴性表達模式的基因。
(B) 上圖:表達1700017N19Rik的間質細胞(由Cyp11a1標記)定位在 IV-VI 期曲細精管附近,但在其他階段不靠近小管。基底膜由白色虛線勾勒。比例尺,20 μm。下圖:總結不同階段組曲細精管附近表達1700017N19Rik的間質細胞百分比的條形圖。
(C) 左:巨噬細胞空間定位示意圖。右圖:巨噬細胞中表現出階段依賴性表達模式的基因。
(D)上圖:表達Efcab6的巨噬細胞(由Adgre1標記)定位在 I-III 期曲細精管附近,但在其他階段不靠近小管。基底膜由白色虛線勾勒。比例尺,20 μm。下圖:條形圖總結了不同階段組曲細精管附近表達Efcab6的巨噬細胞的百分比。
4. 原位RNA測序分析精原細胞微環境的空間
精原細胞 (SPG) 包含干細胞群,以往的研究表明,SPG的自我更新和分化受其周圍微環境的影響。為了系統地分析精原細胞微環境,作者首先在空間上繪制了小鼠(圖 4A)和人類(圖 4E)睪丸中未分化和分化 SPG 的種群。令人驚訝的是,與小鼠相比,作者發現人類未分化和分化SPGs周圍微環境的空間細胞組成存在顯著差異(圖 4F)。對于睪丸間質細胞、內皮細胞和巨噬細胞等體細胞類型尤其如此,但對于支持細胞和肌樣細胞則不然,這表明在人類睪丸中這些體細胞類型之間在塑造精原細胞微環境方面可能存在不同的作用。最后,作者使用多重smFISH證實了這一發現,顯示了人類未分化和分化SPG周圍微環境中內皮細胞的差異富集(圖 4G)。作者的數據揭示了小鼠和人類精原細胞微環境空間結構的顯著差異,表明兩種物種在精子發生的早期階段存在不同的調控機制。
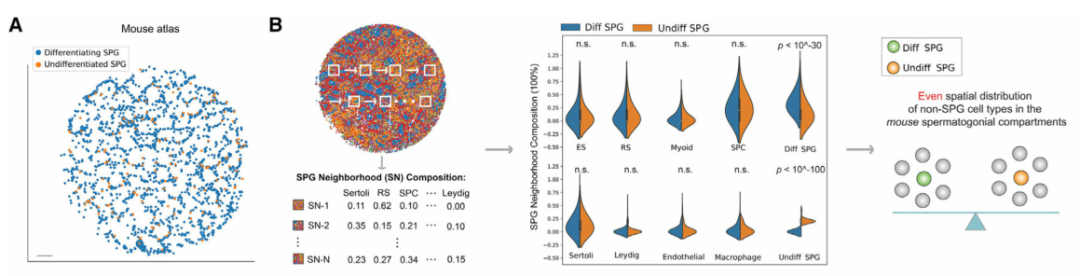
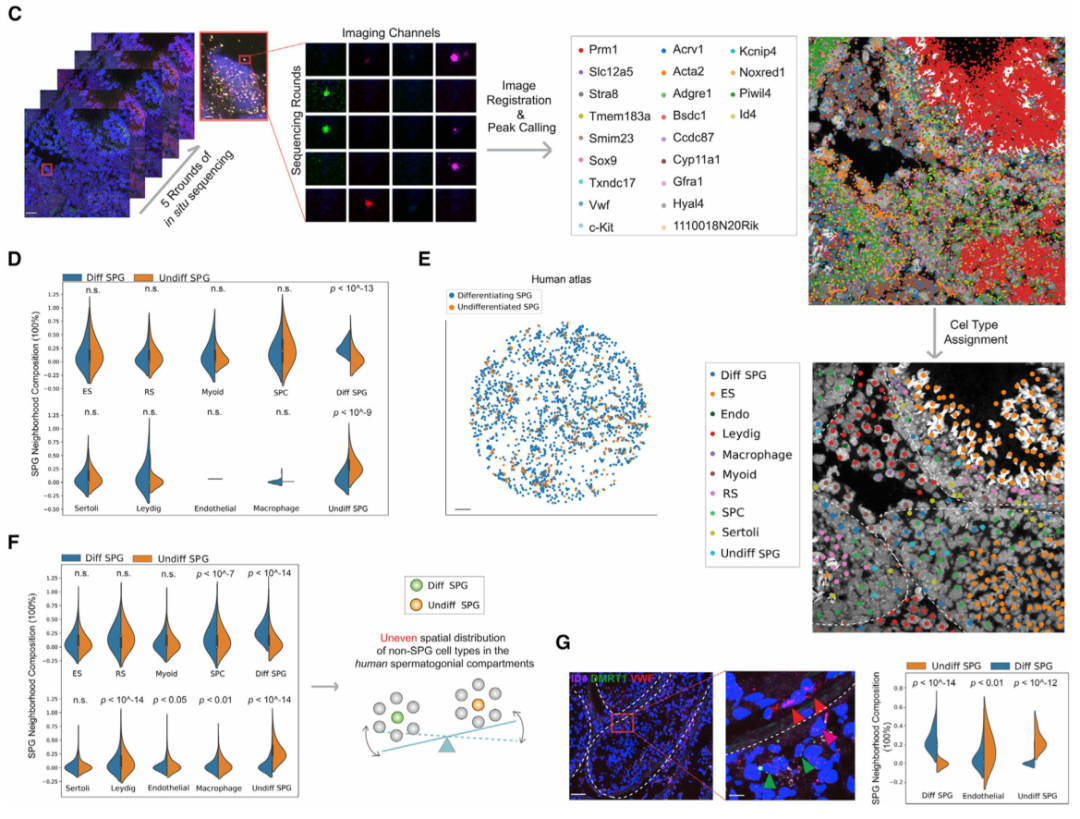
圖 4 小鼠與人類睪丸中的差異干細胞微環境
(A)使用 Slide-seq 數據對小鼠未分化和分化精原細胞進行空間映射。比例尺,300 μm。
(B) K 最近鄰 (KNN) 方法,使用 Slide-seq 數據計算每個小鼠精原細胞周圍微環境中的細胞類型組成。此處顯示了未分化精原細胞與具有 K = 5 個鄰居的分化精原細胞周圍微環境的細胞類型組成的比較。顯示 K = 10 和 15 的圖顯示在圖 S5B中。圖 S5C中顯示了兩個額外的生物學重復。ns,不顯著;ES,伸長中/伸長的精細胞;RS,圓形精子細胞;SPC,精母細胞;Diff SPG,區分精原細胞;Undiff SPG,未分化的精原細胞。
(C)針對 22 個基因的小鼠睪丸樣本的原位測序。ES,伸長中/伸長的精細胞;RS,圓形精子細胞;Diff SPG,區分精原細胞;Undiff SPG,未分化的精原細胞;內皮細胞。白色虛線勾勒出圖像中的曲細精管。比例尺代表 20 μm(插圖為 2 μm)。
(D)使用 (C) 中生成的數據計算未分化小鼠與分化精原細胞周圍微環境的細胞類型組成的 KNN。使用了 K = 5 個鄰居。顯示 K = 10 和 15 的圖顯示在圖 S5E中。ns,不顯著;ES,伸長中/伸長的精細胞;RS,圓形精子細胞;SPC,精母細胞;Diff SPG,區分精原細胞;Undiff SPG,未分化的精原細胞。
(E)使用 Slide-seq 數據對人類未分化和分化精原細胞進行空間映射。比例尺,300 μm。
(F)人類未分化與分化精原細胞周圍微環境的細胞類型組成的比較。使用了 K = 10 個鄰居。圖 S5G顯示了顯示 K = 15 以及不同復制的圖。ns,不顯著;ES,伸長/伸長的精子細胞;RS,圓形精子細胞;SPC,精母細胞;Diff SPG,區分精原細胞;Undiff SPG,未分化的精原細胞。
(G)使用多路復用 smFISH 數據比較人類未分化與分化精原細胞周圍微環境的內皮細胞組成。Diff SPG,區分精原細胞;Undiff SPG,未分化的精原細胞。紅色箭頭,內皮細胞;洋紅色箭頭,未分化的精原細胞;綠色箭頭,區分精原細胞。白色虛線勾勒出圖像中的曲細精管。比例尺代表 70 μm(插圖為 10 μm)。
5. 糖尿病通過破壞曲細精管的空間結構誘發睪丸損傷
最后,作者設想Slide-seq工作流程和計算流程也可以應用于分析精子發生的病理變化。為此,作者從三只瘦素缺陷型糖尿病小鼠 ( ob/ob ) 和三只對照的野生型 (WT) 小鼠中生成了Slide-seq數據。糖尿病(DM)的一個重要并發癥是男性生殖系統的紊亂,然而其潛在機制尚未得到充分認識。作者在空間上繪制已識別的表達差異基因的表達。通過放大單個曲細精管,作者發現Smcp的空間表達模式在ob/ob曲細精管中被破壞(圖 5B)。由于已經證明Smcp的空間表達模式不依賴于階段變化,因此這種破壞不太可能是由于生精上皮周期階段的差異。對ob/ob小管的仔細檢查表明,基因表達模式的變化部分是由于空間細胞組織的改變。在 WT 生精管中,ES(伸長中/伸長的精細胞)在中心聚集在一起,顯示出較高的平均純度評分(圖 5C,左圖)。相比之下,這種空間組織在ob/ob曲細精管中被破壞,其中ES更有可能與其他類型細胞進行空間接觸(圖 5C,右圖)。作者觀察到ES和所有其他類型細胞之間的空間排列發生了顯著變化(圖 5F)。這表明在糖尿病條件下,精子細胞的空間排列最容易受到破壞性影響。總之,作者的分析表明,曲細精管空間結構的破壞是糖尿病引起的睪丸損傷的潛在機制。
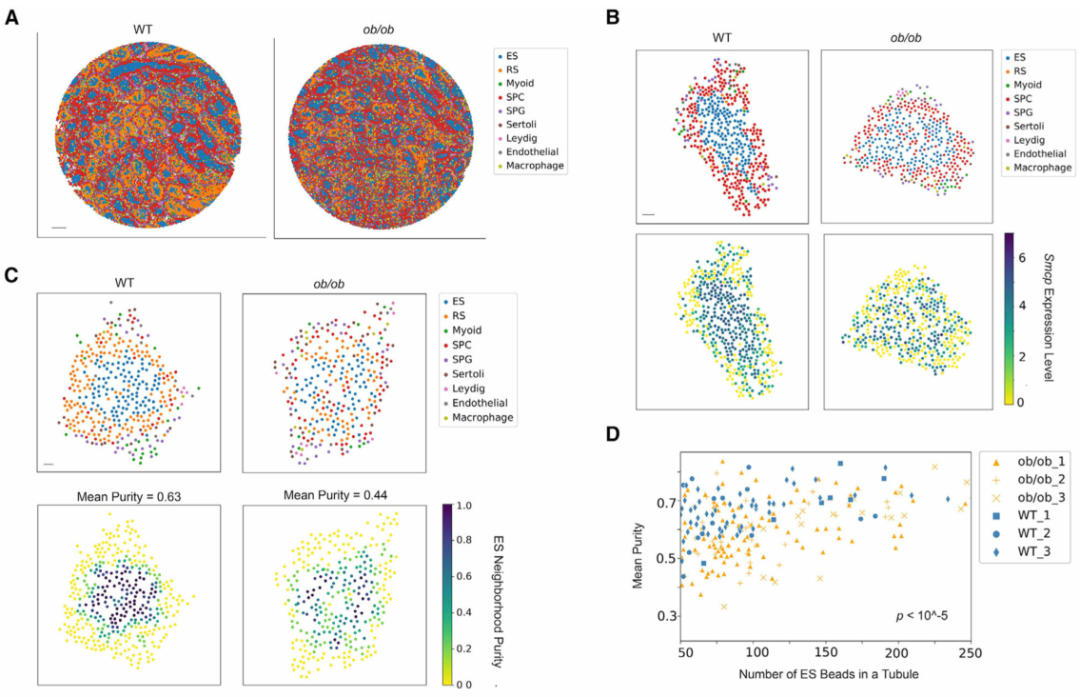
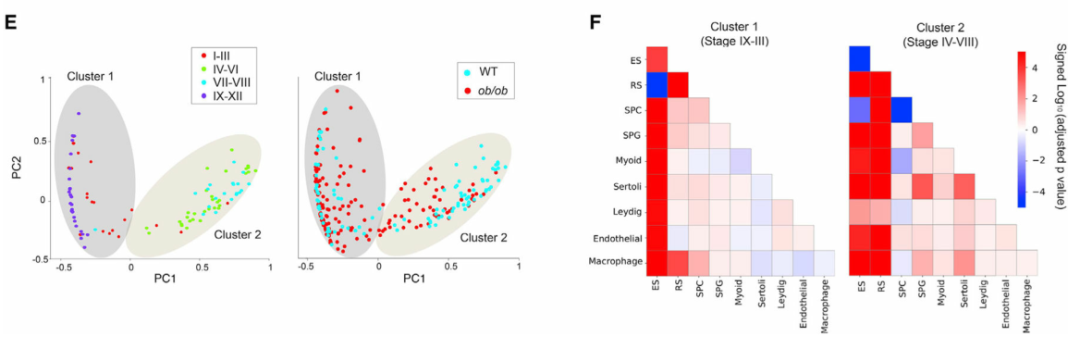
圖 5 糖尿病破壞曲細精管中睪丸細胞類型的空間排列
(A)野生型 (WT) 和ob/ob樣本睪丸細胞類型的空間映射。比例尺,500 μm。
(B) Smcp的空間表達模式在有代表性的ob/ob曲細精管中被破壞。ES,伸長中/伸長的精細胞;RS,圓形精子細胞;SPC,精母細胞;SPG,精原細胞。比例尺,30 μm。
(C)代表 WT 和ob/ob曲細精管中每個Slide-seq珠子的 ES 純度分數,分別。還顯示了每個小管中具有非零值的珠子的平均純度分數。比例尺,30 μm。
(D)來自 WT 和 ob/ob 樣本的每個曲細精管至少有 50 個 ES珠子的平均純度評分。使用 Mann-Whitney U檢驗對兩種條件之間的純度評分進行比較。
(E)左:WT曲細精管中成對空間接觸頻率的主要成分揭示的兩個 WT 曲細精管結構簇。標記每個精管的階段信息。右圖:ob/ob曲細精管投影到左圖中所示的兩個簇上。
(F) Mann-Whitney U檢驗對兩個簇下 WT 和ob/ob曲細精管之間的成對空間細胞接觸頻率。顯示了細胞類型之間空間接觸頻率顯著增加(正)和減少(負)的有符號 p 值。
在小鼠和人類睪丸中,睪丸細胞在曲細精管內和周圍以特定空間組織支持精子發生。在這項研究中,作者分別在空間上繪制了小鼠和人類曲細精管中未分化和分化的精原細胞(SPG)細胞圖譜,微環境分析確定了小鼠和人類睪丸之間未分化和分化精原細胞周圍細胞組成模式的主要差異。關于這些差異如何與這兩個物種中精原干細胞活性的差異調節相關的研究可能會為哺乳動物精子發生的調節機制提供見解。除了分析正常睪丸樣本外,作者還系統地比較了WT和糖尿病曲細精管之間的空間細胞結構。通過計算不同細胞類型之間的空間混合程度和成對細胞接觸頻率,作者觀察到糖尿病曲細精管的空間細胞組織存在顯著破壞,實驗證明細胞和SPG之間的空間接觸頻率發生了顯著變化。證明了曲細精管水平的空間細胞組織的破壞可能是糖尿病損害雄性生育能力的一種機制。
參考文獻
Chen H, Murray E, Sinha A, et al. Dissecting mammalian spermatogenesis using spatial transcriptomics. Cell Rep. 2021;37(5):109915. doi:10.1016/j.celrep.2021.109915

最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










