外泌體-熱門研究方向分享
隨著近幾年外泌體發(fā)文量遞增,眾多科研工作者紛紛扎堆此領(lǐng)域,有關(guān)外泌體載藥、診斷、免疫療法等方向的文章陸續(xù)發(fā)表在各大頂級期刊上,外泌體無疑成為了基礎(chǔ)研究和技術(shù)開發(fā)的熱點,它在疾病診斷,疾病機(jī)理,藥物開發(fā)等方面發(fā)揮著重要的作用。
外泌體概念
外泌體是一種能被機(jī)體內(nèi)大多數(shù)細(xì)胞分泌的具有脂質(zhì)雙分子層膜結(jié)構(gòu)的微小囊泡。動物類外泌體粒徑大小:30 ~ 150 nm,植物類外泌體粒徑大小:50~1000nm,大多數(shù)類型的細(xì)胞都可以分泌外泌體。外泌體廣泛的存在于自然界中,無論是各種動物來源的細(xì)胞和組織,還是我們?nèi)粘I钪谐缘氖卟撕退麕缀醵己型饷隗w。外泌體是人體天然的“運輸員”,攜帶多種蛋白質(zhì)、mRNA、miRNA和脂質(zhì)類物質(zhì)等,它頻繁穿梭于細(xì)胞之間,為細(xì)胞之間的通信提供了橋梁。
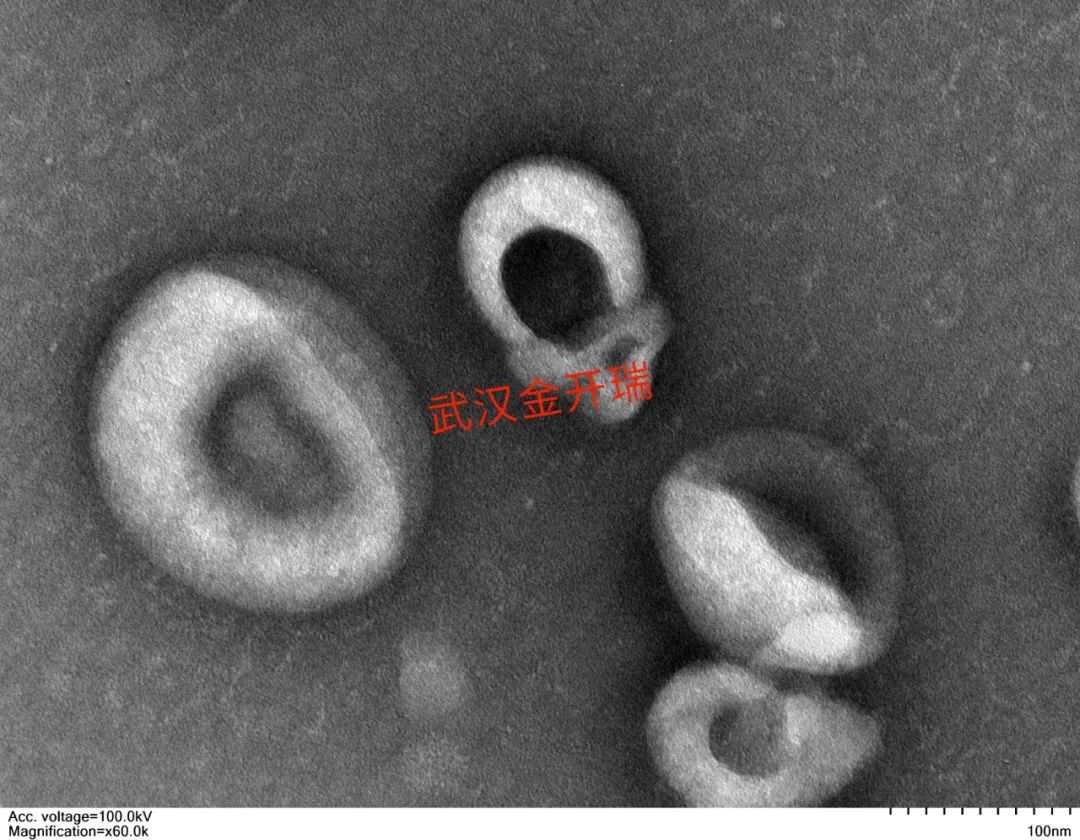
來源:Pegtel DM, Gould SJ. Exosomes. Annu Rev Biochem.[1]
外泌體應(yīng)用
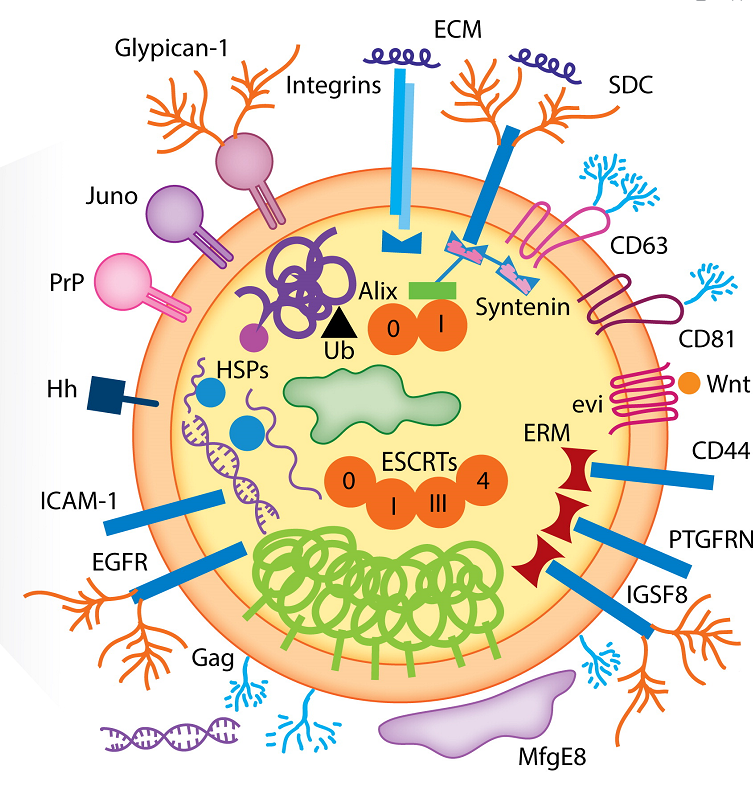
外泌體可以將活性生物分子傳遞到靶細(xì)胞,并在幾種生理和病理過程中具有重要功能,顯示出作為疾病新治療策略的巨大前景。目前外泌體的主要臨床應(yīng)用是將其用作生物標(biāo)志物、無細(xì)胞治療劑、藥物遞送載體、外泌體動力學(xué)基礎(chǔ)分析和癌癥疫苗。來自人類或植物的不同外泌體被用于各種臨床試驗,大多數(shù)研究人員使用來自循環(huán)系統(tǒng)的外泌體進(jìn)行生物標(biāo)志物實驗,越來越多的證據(jù)表明,外泌體在一系列細(xì)胞過程中發(fā)揮著關(guān)鍵作用,包括增殖、生長、發(fā)育、血管生成、免疫調(diào)節(jié)、感染、轉(zhuǎn)移、重編程和重塑。
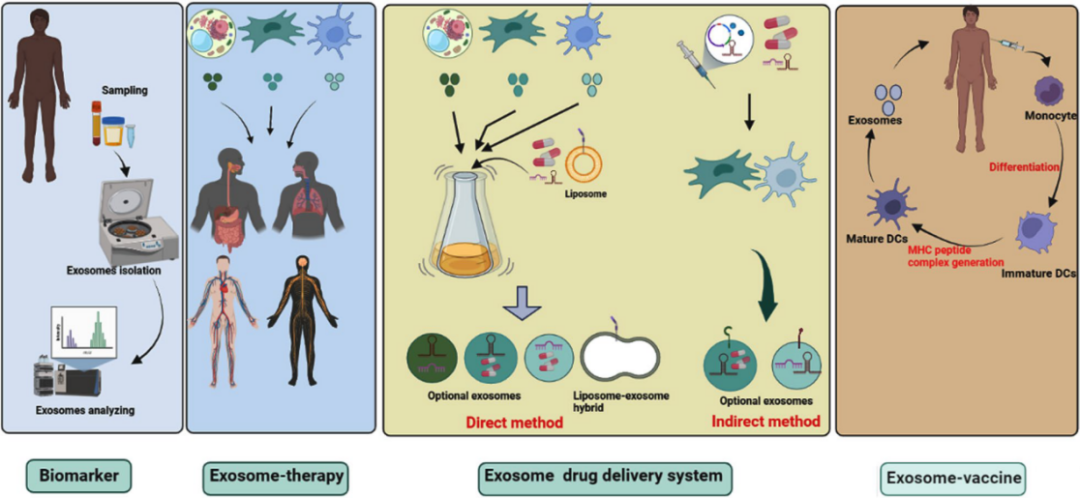
來源:A review on exosomes application in clinical trials: perspective, questions, and challenges[2]
1、外泌體作為診斷標(biāo)志物
很多研究表明,大量外泌體富集于體液中并參與許多生理和病理過程,因此外泌體在液體活檢中作為新型生物標(biāo)志物具有很大的前景。液體活檢的特點是通過血液、唾液和尿液等生物液體進(jìn)行微創(chuàng)檢測,已成為癌癥診斷和預(yù)后預(yù)測的革命性策略。外泌體在大多數(shù)體液中是穩(wěn)定的,可以保護(hù)生物分子免受降解。在病理條件下,細(xì)胞變化可以反映在細(xì)胞釋放的外泌體的生物成分上。除此之外,外泌體的內(nèi)容物可以通過轉(zhuǎn)錄組學(xué)、蛋白質(zhì)組學(xué)和脂質(zhì)組學(xué)研究進(jìn)行鑒定和分析;因此,特定分子水平的差異將有助于生物標(biāo)志物的應(yīng)用。
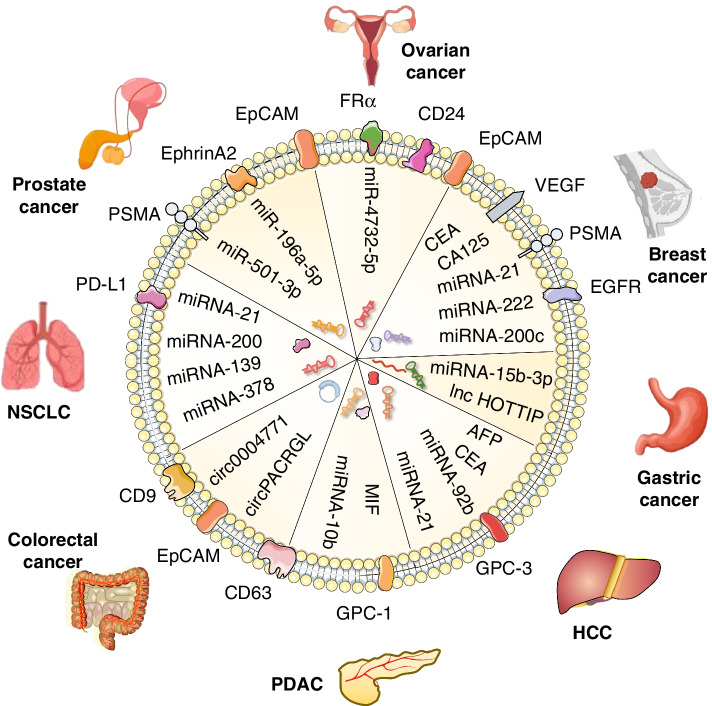
來源:Exosomes as a new frontier of cancer liquid biopsy[3]
2、外泌體用于藥物遞送系統(tǒng)
外泌體具有穩(wěn)定性、低免疫原性和高生物相容性等獨特特性,使其成為理想的藥物遞送載體,這些特征使外泌體能夠有效地進(jìn)入靶細(xì)胞,避免免疫系統(tǒng)的識別和消除,從而將外源蛋白質(zhì)和核酸藥物輸送到靶細(xì)胞。外泌體還具有親脂和親水特性,通過增加藥物溶解度和實現(xiàn)多種藥物的共同遞送來提高藥物利用率,它們還能夠進(jìn)入血腦屏障,并有效地將藥物輸送到腦內(nèi)區(qū)域,此外,還可以修飾外泌體的脂質(zhì)雙層結(jié)構(gòu)以增強(qiáng)其靶向特異性。
隨著動物類外泌體研究的興起,很多人開始把目光轉(zhuǎn)向了植物,植物類外泌體作為一種新興的納米材料,在生物進(jìn)程中扮演著重要的角色。動物來源外泌體存在靶向性不足,進(jìn)入體內(nèi)易被快速清除而無法被靶細(xì)胞吸收,或與細(xì)胞膜發(fā)生相互作用。然而植物外泌體具有免疫原性低、高生物相容性、可改造性強(qiáng)等特點,通過工程化改造外泌體后,可以增強(qiáng)靶向性、避免被免疫系統(tǒng)清除,同時還可讓其裝載內(nèi)容物,可以更好的應(yīng)用于疾病的早期診斷和臨床治療。比如:人參衍生的外泌體納米囊泡可作為一種安全高效的載體,將其所包含的活性miRNAs高效遞送給骨髓間充質(zhì)干細(xì)胞(BMSCs),進(jìn)一步誘導(dǎo)其向神經(jīng)細(xì)胞分化,在體內(nèi)外均顯示出加速神經(jīng)再生與傳導(dǎo)功能修復(fù)的效果。
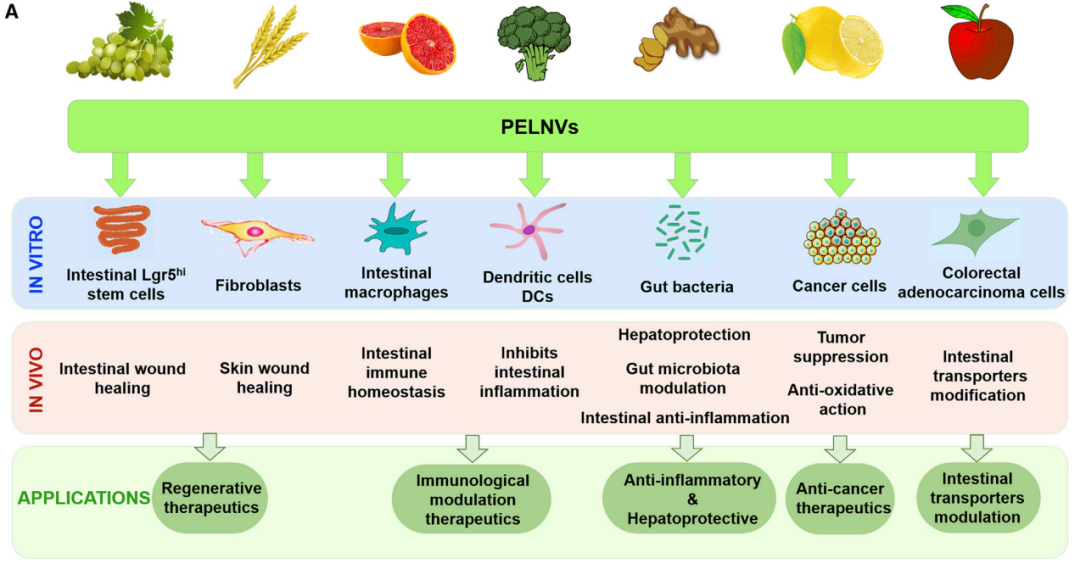
來源:Plant Exosome-like Nanovesicles: Emerging Therapeutics and Drug Delivery Nanoplatforms[6]
3、外泌體用于抗腫瘤免疫治療
外泌體可以很容易地穿過生物屏障,如血腦屏障,其進(jìn)行修飾以提高效率。由于其轉(zhuǎn)移能力、脂質(zhì)雙層結(jié)構(gòu)和獨特的表面蛋白,外泌體可用作藥物、核酸和受體癌細(xì)胞蛋白質(zhì)的納米顆粒載體用于受體癌細(xì)胞,并且天然和改良的外泌體都提供了治療性免疫學(xué)成分以達(dá)到控制和破壞腫瘤細(xì)胞的目的。
鑒于巨噬細(xì)胞在EVs介導(dǎo)的串?dāng)_中發(fā)揮的關(guān)鍵作用,調(diào)節(jié)巨噬細(xì)胞是腫瘤治療的有效策略,因此,由M1巨噬細(xì)胞介導(dǎo)的抑制作用可以應(yīng)用于癌癥治療。負(fù)載有氯素e6光敏劑(Ce6-R-Exo)的腫瘤衍生修飾外泌體可以通過光聲成像可視化,并且可以在激光照射下有效地在腫瘤細(xì)胞中產(chǎn)生活性氧。它們還增加了細(xì)胞因子的釋放,表明 R-Exos 可用作藥物載體和免疫治療劑。
外泌體還含有MHC I等腫瘤抗原,可用作癌癥免疫治療的疫苗,在APC存在下,DC衍生的外泌體可以加載幾種肽抗原(例如,MHC I,MHC II),從而刺激CD4輔助性T細(xì)胞和CD8 CLT誘導(dǎo)抗腫瘤反應(yīng)。
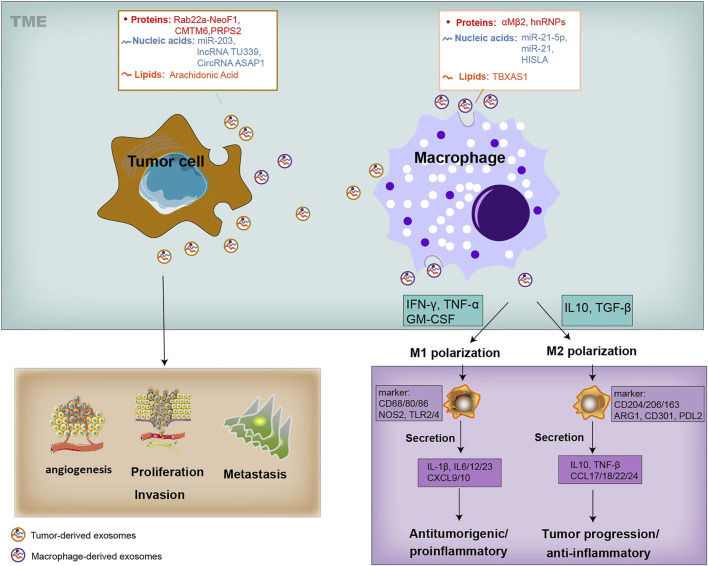
來源:Exosome-Mediated Crosstalk Between Tumor and Tumor-Associated Macrophages[7]
4、外泌體miRNA 研究
外泌體是一種脂質(zhì)雙層細(xì)胞外囊泡,含有不同的成分,包括蛋白質(zhì)、脂質(zhì)、DNA、信使RNA(mRNA)和非編碼RNA。外泌體特殊的膜結(jié)構(gòu)能夠保護(hù)其內(nèi)部的RNA免受酶的降解,相比于體液中的RNA來說,外泌體中各類RNA的含量更為穩(wěn)定,濃度更高。在癌癥中,位于腫瘤細(xì)胞衍生外泌體中的miRNA的表達(dá)失調(diào),可能導(dǎo)致轉(zhuǎn)移和治療耐藥,因此對腫瘤外泌體RNA進(jìn)行相關(guān)研究,揭示外泌體RNA在腫瘤發(fā)生發(fā)展中的分子機(jī)制,將有助于腫瘤的診斷和治療。
小結(jié)
目前,國內(nèi)外相關(guān)的研究火熱進(jìn)行中,如何提高外泌體純度,降低生產(chǎn)成本,實現(xiàn)產(chǎn)品工業(yè)化仍是目前面臨的重大挑戰(zhàn)。相信隨著各領(lǐng)域行業(yè)大咖和高新企業(yè)的加入,將會有更多的外泌體產(chǎn)品問世,最終外泌體的產(chǎn)品將走向商業(yè)化,使更多患者受益。

參考文獻(xiàn):
[1]Pegtel DM, Gould SJ. Exosomes. Annu Rev Biochem. 2019 Jun 20;88:487-514.
[2] Rezaie J, Feghhi M, Etemadi T. A review on exosomes application in clinical trials: perspective, questions, and challenges. Cell Commun Signal. 2022 Sep 19;20(1):145.
[3] Yu D, Li Y, Wang M, Gu J, Xu W, Cai H, Fang X, Zhang X. Exosomes as a new frontier of cancer liquid biopsy. Mol Cancer. 2022 Feb 18;21(1):56.
[4] Xu XH, Yuan TJ, Dad HA, Shi MY, Huang YY, Jiang ZH, Peng LH. Plant Exosomes As Novel Nanoplatforms for MicroRNA Transfer Stimulate Neural Differentiation of Stem Cells In Vitro and In Vivo. Nano Lett. 2021 Oct 13;21(19):8151-8159.
[5] Zeng H, Guo S, Ren X, Wu Z, Liu S, Yao X. Current Strategies for Exosome Cargo Loading and Targeting Delivery. Cells. 2023 May 17;12(10):1416.
[6] Dad HA, Gu TW, Zhu AQ, Huang LQ, Peng LH. Plant Exosome-like Nanovesicles: Emerging Therapeutics and Drug Delivery Nanoplatforms. Mol Ther. 2021 Jan 6;29(1):13-31.
[7] Chen Q, Li Y, Gao W, Chen L, Xu W, Zhu X. Exosome-Mediated Crosstalk Between Tumor and Tumor-Associated Macrophages. Front Mol Biosci. 2021 Oct 13;8:764222.
最新動態(tài)
-
09.23
中藥的現(xiàn)代詮釋:外泌體如何革新傳統(tǒng)醫(yī)學(xué)?
-
07.02
1+1>2!深度解析RNA測序數(shù)據(jù)挖掘邏輯和后期實驗設(shè)計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學(xué)與美學(xué)的結(jié)合體:植物亞細(xì)胞定位技術(shù)詳解
-
06.28
“聚焦新質(zhì)生產(chǎn)力,激發(fā)科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(shù)(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準(zhǔn)、直觀、實時——取經(jīng)“蛋白互作研究翹楚”BIFC!
-
05.14
轉(zhuǎn)染效率低、干擾效果差、重復(fù)性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術(shù)核心要點,讓“emsa” 秒變“easy”
-
 在線客服
在線客服 -

 在線訂購
在線訂購 -

 掃碼領(lǐng)資料
掃碼領(lǐng)資料掃碼領(lǐng)資料

電話:19522948401
-

 文獻(xiàn)獎勵申請
文獻(xiàn)獎勵申請


