表觀遺傳 | 超級增強子相關lncRNA如何影響肝癌
前言:增強子(enhancer),是距離啟動子較遠距離的一段可與蛋白質(反式作用因子,trans-acting factor)結合的區域,可以被轉錄因子等蛋白結合從而激活基因轉錄。增強子在不同類型細胞以及不同發育階段會有不同活性,并且與轉錄因子(Transcript Factor, TF)等蛋白的結合也具有特異性,因此增強子是調控基因特異性表達重要的順式作用元件(Cis-regulatory element)(Fig 1)[1]。
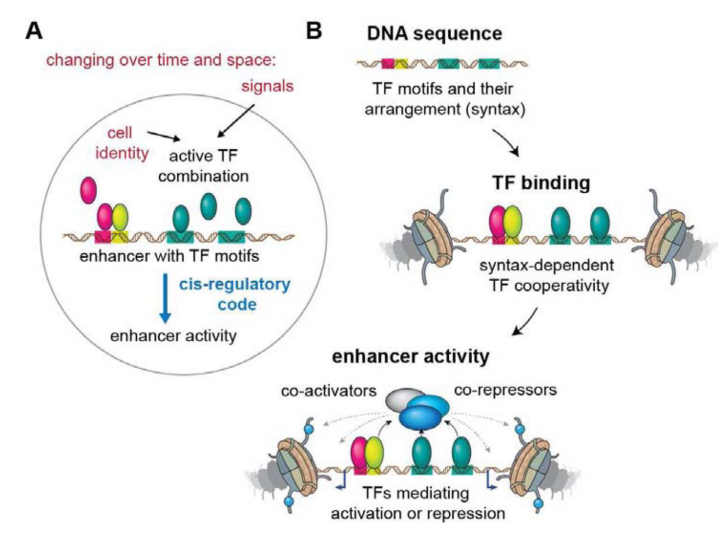
Figure 1 轉錄因子調控增強子活性示意圖[1]。(A)在不同時空中,特定TF通過轉錄或細胞外信號進行識別motif序列與增強子結合并激活增強子。(B)順式調控元件含有特定的TF基序(motif)。TF招募共激活因子或共阻遏因子,其調控增強子的活性。
在后生動物中,啟動子具有H3K4me3標記,同樣增強子在基因組上也有特殊的身份標記——增強子特征是具有染色質開放性和組蛋白H3K4me1修飾,活性增強子(Active Enhancer)具有H3K27ac標記,靜態/起始增強子(Poised/Primed Enhancer)缺少H3K27ac標記(Fig 2)[2]。因此我們可以根據CUT&TAG、ChIP-seq和ATAC-seq等技術鑒定增強子位點。
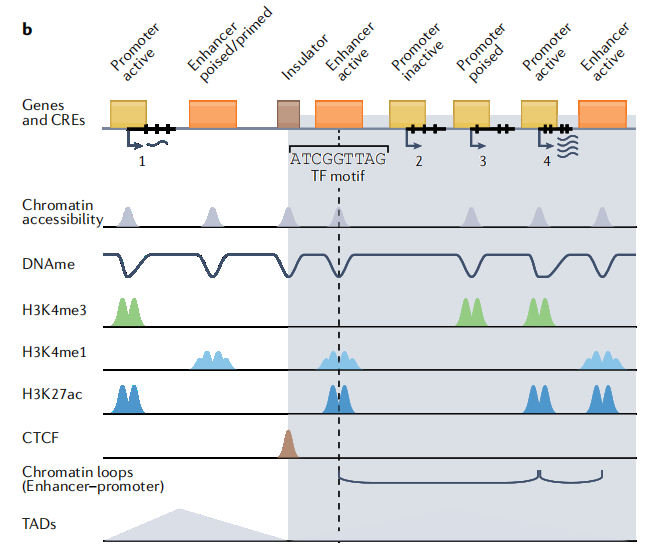
Figure 2 順式調控元件基因組特征[2]。增強子特征是具有染色質開放性和組蛋白H3K4me1修飾,活性增強子(Active Enhancer)具有H3K27ac標記,靜態/起始增強子(Poised/Primed Enhancer)缺少H3K27ac標記。
隨著對增強子在轉錄調控作用研究的深入,Richard A. Young團隊于2013年提出超級增強子概念——超級增強子(Super-enhancer, SE)比普通增強子(Typical enhancer,TE)具有更高的轉錄激活相關組蛋白修飾(H3K27ac、H3Kme1等)、Mediator復合體和BRD4蛋白(Bromodomain containing 4)及轉錄因子的富集密度,超級增強子區域長度通常可達8-20 Kb,遠高于普通增強子的200-300 bp長度[3]。長非編碼RNA(lncRNA)的異常表達已在多種癌癥中屢見報道,而SE與lncRNA關聯的新研究思路近年來初露鋒芒。SE-lncRNA就是超級增強子關聯的lncRNA,它緊靠SE并且其轉錄活性受到SE的調控。這里小編分享2篇近期的肝癌方面SE-lncRNA高水平研究,幫助各位老師了解SE-lncRNA課題研究思路。
一、超級增強子驅動的lncRNA-Daw通過激活Wnt/b-catenin途徑促進肝癌細胞增殖
廣州中醫藥大學張錦芳團隊2021年在Mol Ther Nucleic Acids. 發表Super-enhancer-driven lncRNA-DAW promotes liver cancer cell proliferation through activation of Wnt/β-catenin pathway一文揭示了lncRNA-DAW在肝癌發展中的作用機制[4]。
1、首先比較各人體組織中H3K27ac ChIP-seq數據,以篩選肝部特異性SE(Fig 3)。與其他實體瘤相似,在肝細胞癌(HCC)中也經常檢測到基因組DNA拷貝數的擴增,包括20q13.12的擴增,既往研究表明,20q13.12片段的獲得與肝癌患者的肝轉移、總生存期及不良預后顯著相關。而20q13.12片段在HCC中有比正常細胞更高的H3K4me1和H3K27ac信號,該位點可能含有肝臟特異性超級增強子。
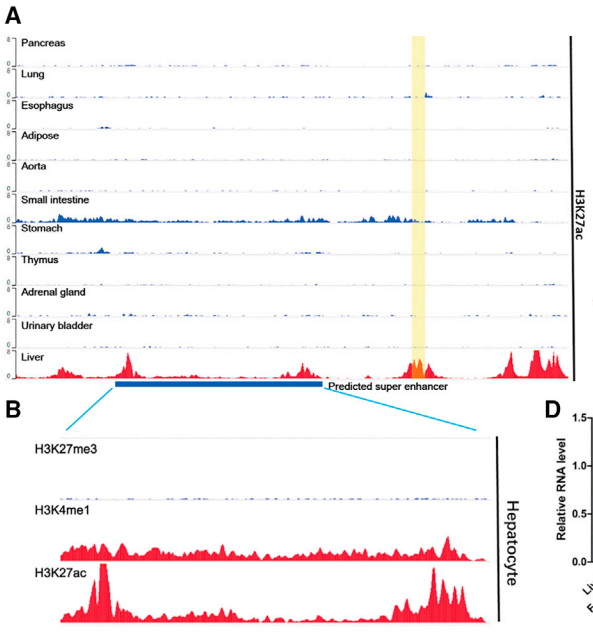
Figure 3 人各組織H3K27ac數據[4]。(A) 一組正常人體組織中lncRNA DAW(LINC01430)基因座的H3K27ac-ChIP-seq數據。黃色區域表示lncRNA DAW的位點。(B) 肝細胞中lncRNA DAW基因座的超級增強子組蛋白標記的ChIP-seq數據。
2、在該SE區域鑒定到8個此前未報道的lncRNA,根據RNA-seq數據,此前被稱為lncRNA-DAW的lncRNA在肝組織中高表達。比較肝細胞癌(HCC)和正常細胞中表達量,發現lncRNA-DAW顯著上調。因此,作者將它確定后HCC候選靶點lncRNA進行進一步細胞和動物實驗。
3、超級增強子經常被各種轉錄因子占據以發揮作用,作者篩選lncRNA-DAW所在SE依據UCSC基因組瀏覽器和Cistrome數據庫候選結合的TF,發現該基因位點與肝細胞核因子家族成員HNF4G結合。根據ChIP-seq實驗、雙熒光素酶實驗和RT-PCR實驗,HNF4G 與候選區域中的SE-1 和 SE2結合,并且HNF4G促進lncRNA-DAW表達。
4、作者通過體外過表達和裸鼠實驗證明lncRNA-DAW促進癌細胞增殖和轉移。對lncRNA-DAW過表達細胞進行RNA-seq,對癌癥相關通路中選擇候選基因進行RT-qPCR實驗和siRNA干擾實驗,Wnt2基因表現受到lncRNA-DAW調控。
5、根據此前報道lncRNA可能與多梳蛋白抑制復合物(Polycomb repressive complexes, PRC)結合,作者發現PRC核心成分EZH2會抑制Wnt2表達。根據ChIP-seq實驗發現,EZH2會結合Wnt2啟動子從而抑制轉錄。
6、作者通過RIP-qPCR驗證EZH2會結合lncRNA-DAW,lncRNA-DAW過表達后EZH2對Wnt2啟動子抑制效果下降。由于過去報道多種lncRNA可以調節RNA結合蛋白的磷酸化和穩定性,于是作者通過WB驗證了lncRNA-DAW的瞬時過表達以劑量依賴性方式降低內源性EZH2蛋白量。
7、依據細胞和動物實驗作者證明Wnt2激活了Wnt/β-catenin通路促進癌細胞增殖。作者根據50對肝癌表達譜數據發現HCC標本中lncRNA-DAW和Wnt2的表達之間的顯著正相關,lncRNA-DAW和Wnt2表達的增加可能是人類HCC組織中的常見事件,表明lncRNA-DAW和Wnt2可能作為肝癌患者的假定治療靶點(Fig 4)。
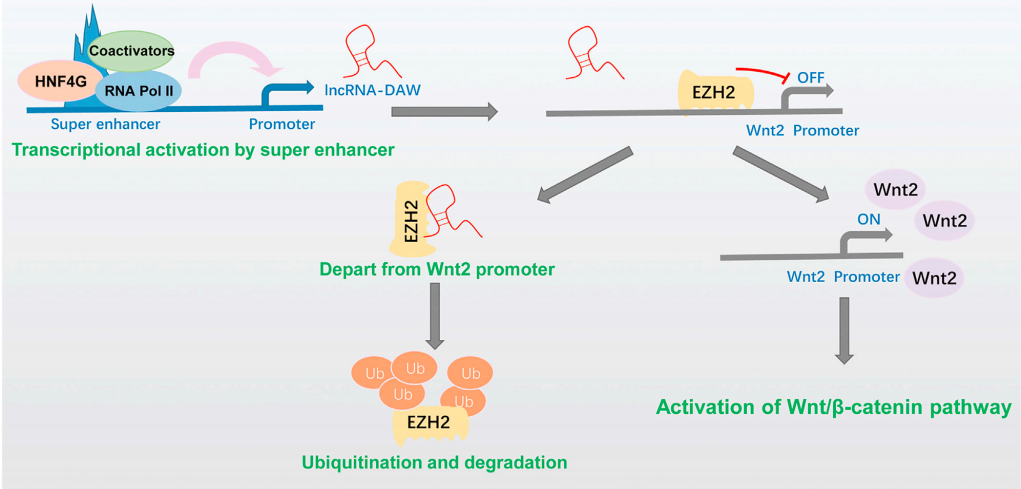
Figure 4 lncRNA-DAW調控Wnt2促進肝癌細胞增殖示意圖[4]。
二、lncRNA FASRL促進脂肪酸生物合成并加劇肝癌進展
中山大學彭麗團隊于去年在Advanced Science上發表了題為“Upregulation of Superenhancer-Driven LncRNA FASRL by USF1 Promotes De Novo Fatty Acid Biosynthesis to Exacerbate Hepatocellular Carcinoma”文章。研究發現了一種名為FASRL 的lncRNA表達受超級增強子調控,表達上調后可以促進脂肪酸的從頭合成,從而促進肝細胞癌的發生[5]。
1、作者通過HepG2、Huh7、PLC、LM3(四種肝癌細胞系)和正常肝組織的H3K27ac數據,篩選并鑒定了由HCC細胞中異常超級增強子調節的lncRNA(Fig 5)。作者鑒定到31個肝癌特異性SE相關的lncRNA,其中3個lncRNA在HCC樣本中上調,其高表達與HCC患者預后較差相關。作者將其中表達差異最大的1個lncRNA命名為 “FASRL”并作為候選肝癌靶點SE-lncRNA。FASRL位于16號染色體上,長度為15551 bp,包含兩個外顯子和一個內含子。
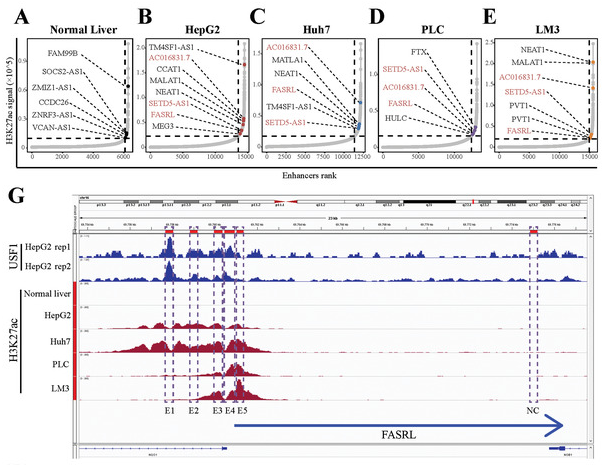
Figure 5 篩選肝癌特異性超級增強子[5]。A-E. 正常肝組織和四種肝癌細胞系超級增強子,FASRL是四種癌細胞系共有的特異性超級增強子,虛線代表ROSE軟件判斷SE的閾值。G. FASRL處H3K27ac信號,虛線為增強子位點,四種肝癌細胞中存在較高H3K27ac信號,而正常肝細胞中不存在。
2、作者將FASRL的五個增強子序列進行雙熒光素酶實驗,增強子E4對FASRL表達增強效果最強。為了探究SE調控FASRL表達上游機制,作者對FASRL序列進行轉錄因子motif分析,把將排名前十的TF表達量與FASRL表達量進行相關性分析,相關性最高的是熱休克轉錄因子1(HSF1)。之后通過siRNA和ChIP-qPCR實驗證明TF USF1可以通過與HCC中的SE結合來轉錄驅動FASRL表達(Fig 6)。
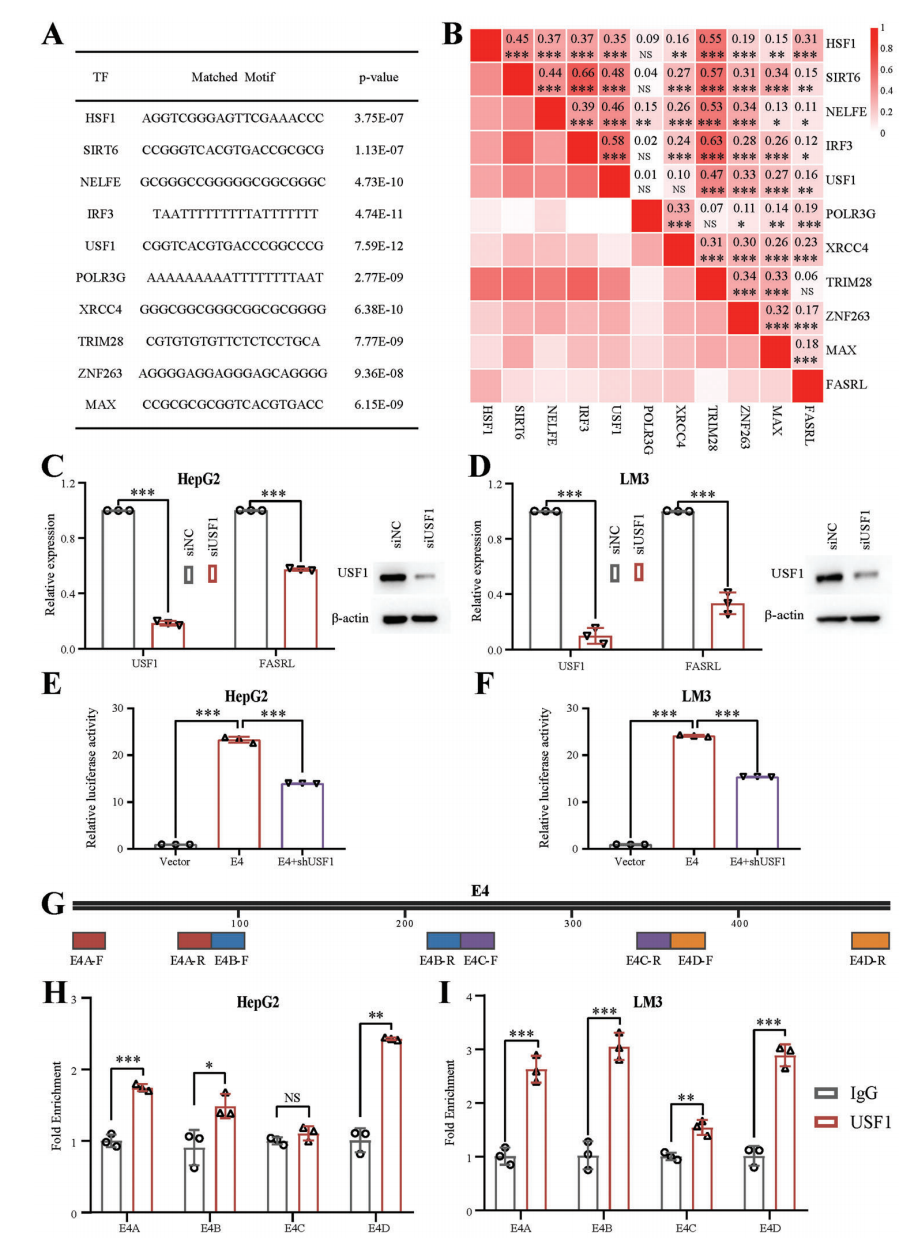
Figure 6 驗證HSF1是調控FASRL的轉錄因子[5]。A. FASRL區域序列前10可能結合的TF motif序列。B. 10個TF和FASRL表達相關性。C,D. siRNA干擾USF1后HepG2和LM3細胞系中USF1和FASRL表達量和蛋白含量。E,F. 雙熒光素酶實驗顯示了shRNA敲低USF1后E4的轉錄活性下降。G. 在E4序列上設計了4對ChIP-qPCR引物,H圖為USF1結合SE的ChIP-qPCR結果。
3、作者進行體外實驗驗證FASRL是否能夠影響肝癌細胞進展。通過siRNA敲低FASRL后細胞增殖、細胞遷移、細胞凋亡證明FASRL可以促進HCC細胞的致癌生長。之后將穩定轉染shFASRL或shNC的HCC細胞系皮下注射到裸鼠中,觀測到shFASRL顯著減緩了裸鼠中腫瘤細胞的增殖。
4、為了揭示FASRL的特定下游調控途徑,作者依據siFASRL轉錄組數據進行基因集富集分析(GSEA),FASRL敲低與脂肪酸(FA)途徑相關基因的表達呈顯著負相關,之后進行RT-qPCR和WB實驗驗證了這個發現(Fig 7)。
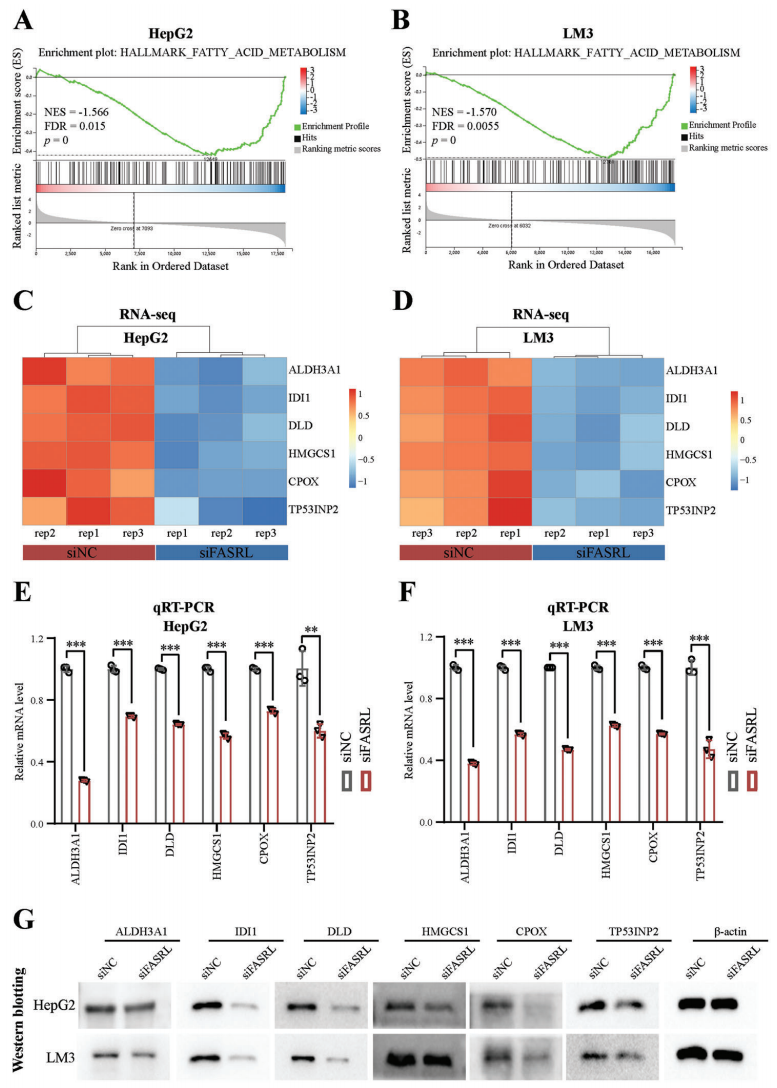
Figure 7 FASRL參與HCC脂肪酸代謝通路[5]。A,B 敲除FASRL表達后表達改變的基因在脂肪酸(FA)代謝通路中富集。C,D qRT-PCR顯示FASRL表達下調后,FA代謝通路中表達顯著改變的基因表達量熱圖。E,F FASRL的表達下調后,FA代謝通路中基因的mRNA表達顯著下調。G. WB顯示FASRL 表達在 HepG2 和 LM3 細胞系中敲低后 FA 代謝途徑中基因的蛋白質含量改變。
5、為了進一步探索與FASRL直接相互作用的蛋白質,作者使用RNA Pull Down-MS鑒定與FASRL直接相互作用的RNA結合蛋白,MS結果顯示乙酰輔酶A羧化酶1(ACACA)直接與FASRL結合,之后進行RIP-qPCR、FISH、IHC和WB進行進一步驗證。先前的研究表明,ACACA (Ser79) 的磷酸化抑制其酶活性并減少 FA 合成,而本研究發現敲低FASRL表達增加了磷酸化ACACA的水平,FASRL與ACACA結合并抑制其磷酸化,從而增加了FA的合成。
6、ACACA是脂質代謝中的重要酶,是控制從頭FA生物合成的中心酶。作者用同位素13C6-標記葡萄糖追蹤FA合成,證明敲低FASRL抑制了從頭FA合成,另外FASRL敲低顯著降低了甘油三酯(TG)含量。之后通過油紅O染色實驗和對脂滴熒光標記進一步驗證了在敲低FASRL表達后HCC細胞中的脂滴數量顯著減少。
7、綜上所述,這項工作發現USF1可以通過SE驅動FASRL表達,FASRL和ACACA之間的相互作用增加FA合成,以促進腫瘤進展(Fig 8)。作者期望未來開發抑制TF USF1或SE的藥物來降低FASRL的表達或抑制FASRL與ACACA的結合以減少FA合成,最終達到抑制HCC的目的。
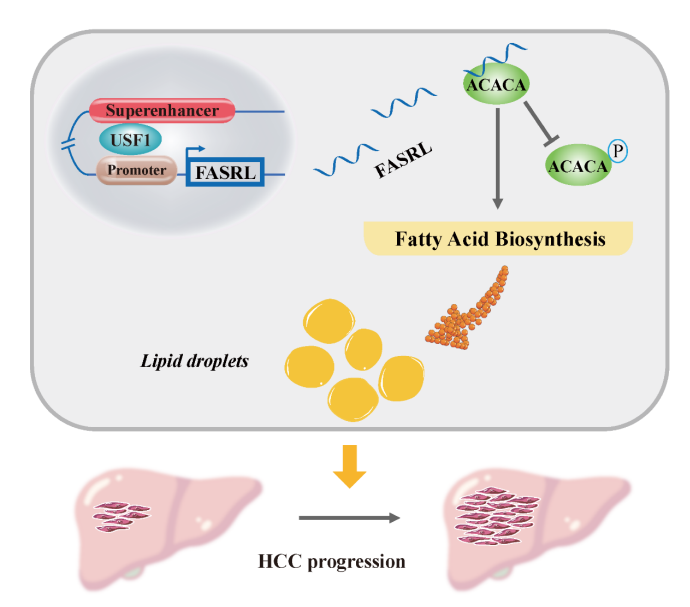
Figure 8 SE-lncRNA FASRL影響肝癌進展機制[5]。
總結以上兩篇文章中涉及實驗有ChIP-seq、ChIP-qPCR、RNA-seq、RIP-qPCR、RNA Pull down-MS、雙熒光素酶報告基因、CoIP-MS、細胞功能實驗、動物建模實驗等。對于這些實驗,武漢金開瑞生物均有大量項目經驗,可助力您課題研究,歡迎各位老師咨詢!

參考文獻:
[1] Zeitlinger J. Seven myths of how transcription factors read the cis-regulatory code. Curr Opin Syst Biol. 2020;23:22-31. doi:10.1016/j.coisb.2020.08.002
[2] Preissl S, Gaulton KJ, Ren B. Characterizing cis-regulatory elements using single-cell epigenomics. Nat Rev Genet. 2023;24(1):21-43. doi:10.1038/s41576-022-00509-1
[3] Whyte WA, Orlando DA, Hnisz D, et al. Master transcription factors and mediator establish super-enhancers at key cell identity genes. Cell. 2013;153(2):307-319. doi:10.1016/j.cell.2013.03.035
[4] Liang W, Shi C, Hong W, et al. Super-enhancer-driven lncRNA-DAW promotes liver cancer cell proliferation through activation of Wnt/β-catenin pathway. Mol Ther Nucleic Acids. 2021;26:1351-1363. Published 2021 Nov 3. doi:10.1016/j.omtn.2021.10.028
[5] Peng JY, Cai DK, Zeng RL, et al. Upregulation of Superenhancer-Driven LncRNA FASRL by USF1 Promotes De Novo Fatty Acid Biosynthesis to Exacerbate Hepatocellular Carcinoma [published online ahead of print, 2022 Oct 28]. Adv Sci (Weinh). 2022;10(1):e2204711. doi:10.1002/advs.202204711
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










