【客戶文章分享】SHMT2 通過 5′UTR 依賴性 ADAM10 翻譯啟動介導小分子誘導的阿爾茨海默病病理學緩解過程
長期以來,人們一直認為一碳代謝(OCM)與阿爾茨海默病(AD)相關,但潛在的機制仍然不明確。利用化學生物學的優勢,作者發現線粒體絲氨酸羥甲基轉移酶2(SHMT2)直接調節ADAM金屬蛋白酶結構域10(ADAM10)的翻譯,后者是AD的治療靶點。發現小分子Kenpaullone(KEN)通過5'UTR促進ADAM10的翻譯,并改善APP/PS1小鼠的認知功能。SHMT2作為KEN的靶基因和5'UTR相互作用的RNA結合蛋白(RBP)介導了KEN誘導的ADAM10在體內外的翻譯。SHMT2通過與大量RNA結合控制AD信號通路,并通過與GAGGG基序直接相互作用增強ADAM10的5'UTR活性,而這個基序影響了5'UTR中的核糖體掃描。綜上所述,KEN通過將OCM與RNA處理聯系起來,展現了治療AD的潛力,在這一過程中,代謝酶SHMT2通過結合GAGGG基序并促進5'UTR依賴的ADAM10翻譯起始,起到了“雙重身份”的作用。
研究方法與結果
01、KEN增加了人類和小鼠細胞中的ADAM10表達
KEN已被證實可調節線粒體中parkin的招募,預防聽力損失,并增加神經元分化,延長運動神經元的健康壽命。雖然這種分子似乎具有抗癌活性,但在神經退行性疾病中也具有抗凋亡作用。作者首先在SH-SY5Y細胞中測量了ADAM10蛋白水平,發現KEN在0.5至2μM濃度下顯著增加了m-ADAM10的表達。進一步研究顯示,這種效應不是由于KEN抑制CDKs和GSK-3引起的。而且,KEN還在人類和小鼠細胞中增強了ADAM10蛋白水平,且不引起明顯細胞毒性。免疫熒光圖像顯示,KEN顯著增加了SH-SY5Y細胞中ADAM10蛋白的表達水平。此外,KEN還使Aβ42水平顯著降低,表明KEN增強的ADAM10在Aβ的產生中具有功能作用。
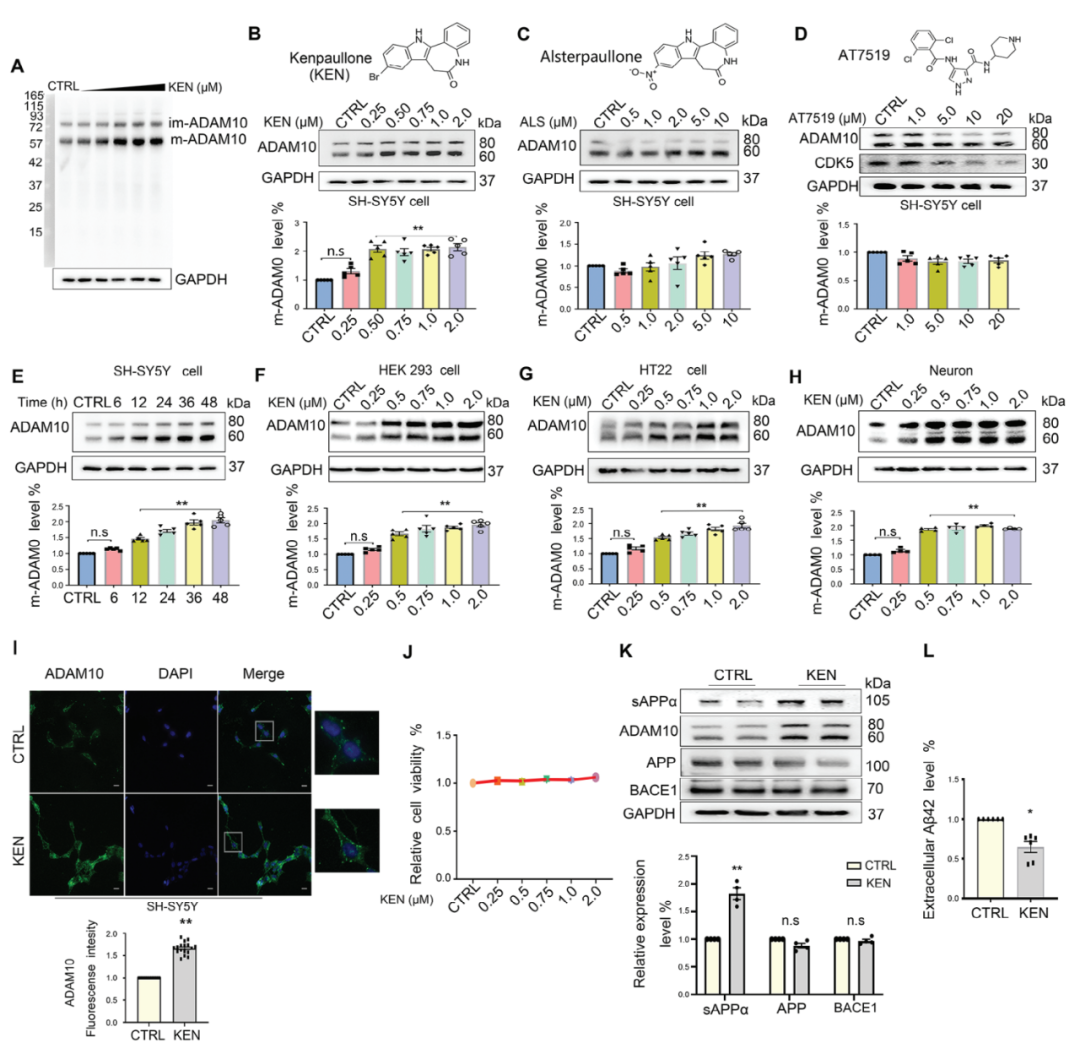
圖1: Kenpaullone(KEN)增加了人類和小鼠細胞中的ADAM10蛋白水平
02、KEN介導的ADAM10增強依賴于5'UTR
KEN導致ADAM10增強可能是由于轉錄、翻譯或蛋白質降解的改變,因此作者首先在SH-SY5Y細胞中測量了mRNA水平。如圖2A所示,KEN并未改變ADAM10 mRNA水平。轉錄抑制劑放線菌素D(ActD)或蛋白質合成抑制劑環己亞胺(CHX)單獨導致ADAM10蛋白水平降低,而KEN誘導的ADAM10增強在CHX存在時減弱,但在ActD存在時沒有減弱(圖2B),表明涉及蛋白質合成。看來蛋白質降解機制不涉及這種調節,因為蛋白酶體抑制劑MG132或溶酶體抑制劑氯喹(CQ)未能阻止KEN介導的ADAM10增強(圖2C)。此外,作者排除了CDKs/GSK-3在ADAM10調節中的作用,因為單獨沉默CDK5或GSK-3β并不改變基礎條件下的ADAM10蛋白,并且未能進一步阻止KEN誘導的ADAM10蛋白水平增強(圖2D,E)。因此,作者接下來評估了翻譯機制是否介導了KEN的效應。如圖2F所示,翻譯抑制劑4EGI1,它破壞了真核翻譯起始因子E(eIF4E)-eIF4G相互作用,顯著降低了ADAM10蛋白的基礎水平,并進一步減弱了KEN對ADAM10的增強作用。通過轉染ADAM10構建,其中包括或刪除了5'UTR,作者發現5'UTR的缺失明顯增強了ADAM10的基礎水平,如先前報道的那樣,并且在−5'UTR但不是在+5'UTR中KEN誘導的ADAM10增強被減弱(圖2G)。進一步的5'UTR-熒光酶分析顯示核苷酸1–144和145–414足以介導KEN的功能(圖2H),而BACE1的5'UTR活性未發生改變(圖2I),這闡明了對ADAM10的選擇性調節。這些結果表明KEN通過5'UTR誘導ADAM10的翻譯。
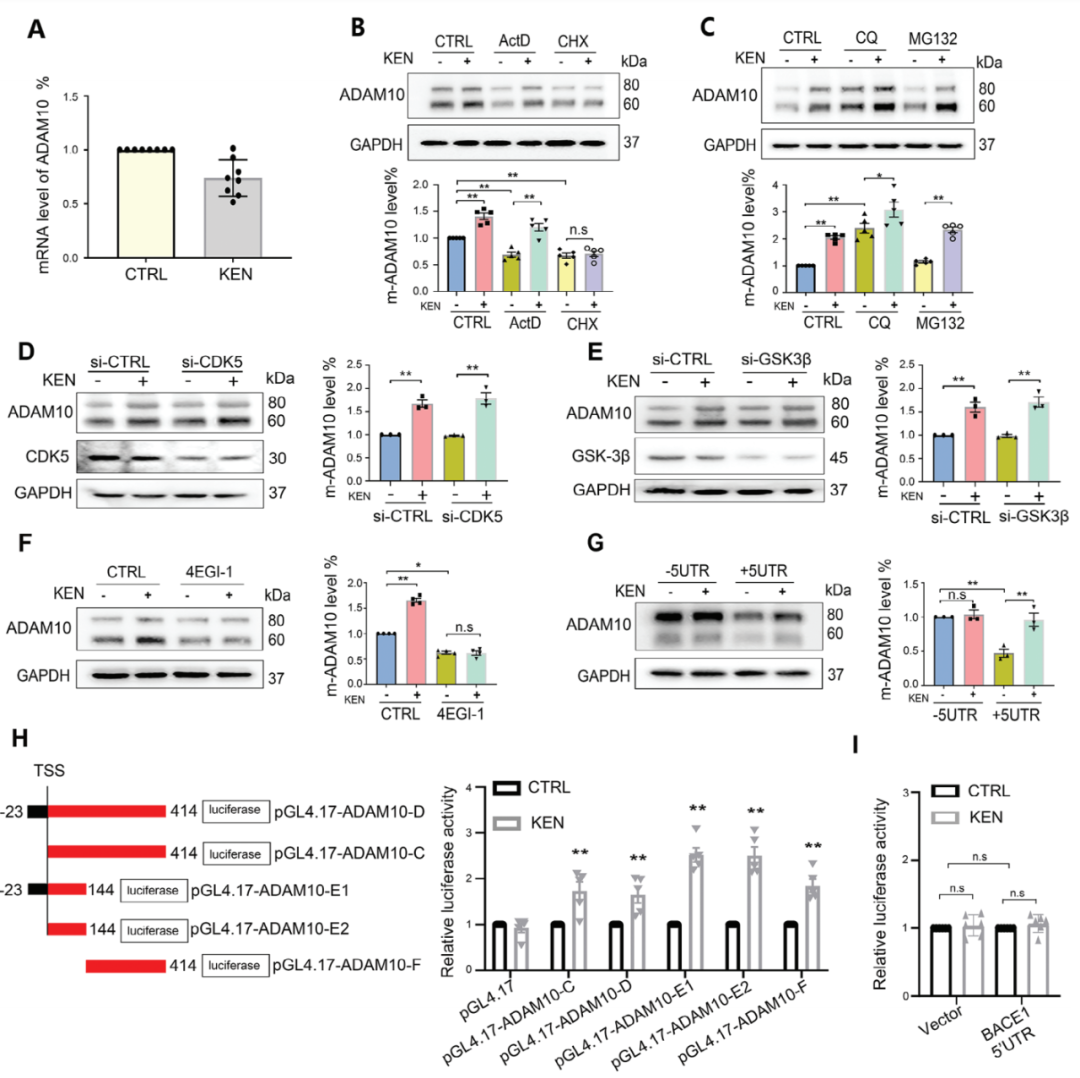
圖2. KEN誘導的ADAM10翻譯依賴于5'UTR
03、KEN促進了APP/PS1小鼠中ADAM10的表達并改善了認知缺陷
作者接下來確定增強的ADAM10表達是否與體內淀粉樣蛋白生成和認知功能的改變相關聯(見圖3A)。野生型(WT)和APP/PS1小鼠被腹腔注射給予對照組(CRTL)或KEN,從而產生了以下四個組:WT、WT-KEN、APP/PS1和APP/PS1-KEN。鑒于KEN是CDK和GSK-3的抑制劑,這些蛋白激酶已知在選擇性位點包括Ser262(Tau262)和Ser396(Tau396)上磷酸化Tau,而這些磷酸化位點在APP/PS1小鼠的大腦中升高。因此,通過測量Tau262/396水平可以驗證KEN在大腦中的有效性。此外,ADAM10的底物之一,神經膠質相關細胞粘附分子(NrCAM),用于評估ADAM10激活劑的副作用。如圖3B所示,相對于APP/PS1小鼠,APP/PS1-KEN的Tau262/396蛋白水平顯著降低,表明KEN成功到達大腦并發揮了生物功能。ADAM10和sAPP的蛋白水平在WT和APP/PS1小鼠中均顯著升高,而NrCAM的水平未顯著升高,表明KEN選擇性地增強了ADAM10而避免了與神經突觸生長相關的副作用。作者進一步顯示在KEN治療的APP/PS1小鼠中,ADAM10蛋白水平的增強伴隨著Aβ沉積的減少。為了確定KEN是否會影響認知功能,作者使用水迷宮測試和上下文恐懼條件測試評估了APP/PS1小鼠的空間和聯想學習記憶。在隱藏平臺測試中,APP/PS1-KEN小鼠的逃避潛伏期顯著短于APP/PS1小鼠,從第三天開始(見圖3E)。在探索試驗中,當移除平臺時,APP/PS1-KEN小鼠在目標象限停留的時間(見圖3F)和穿越目標位置的通過時間(見圖3G)顯著長于APP/PS1小鼠,表明KEN改善了空間記憶(見圖3H)。隨后的上下文恐懼條件測試顯示,在APP/PS1-KEN小鼠中,凍結的次數(凍結次數)顯著增加,凍結的持續時間(凍結時間)顯著延長,與APP/PS1小鼠相比(見圖3I、J)。WT和WT-KEN之間未觀察到顯著差異。這些結果表明KEN顯著改善了APP/PS1小鼠的空間和聯想學習記憶。
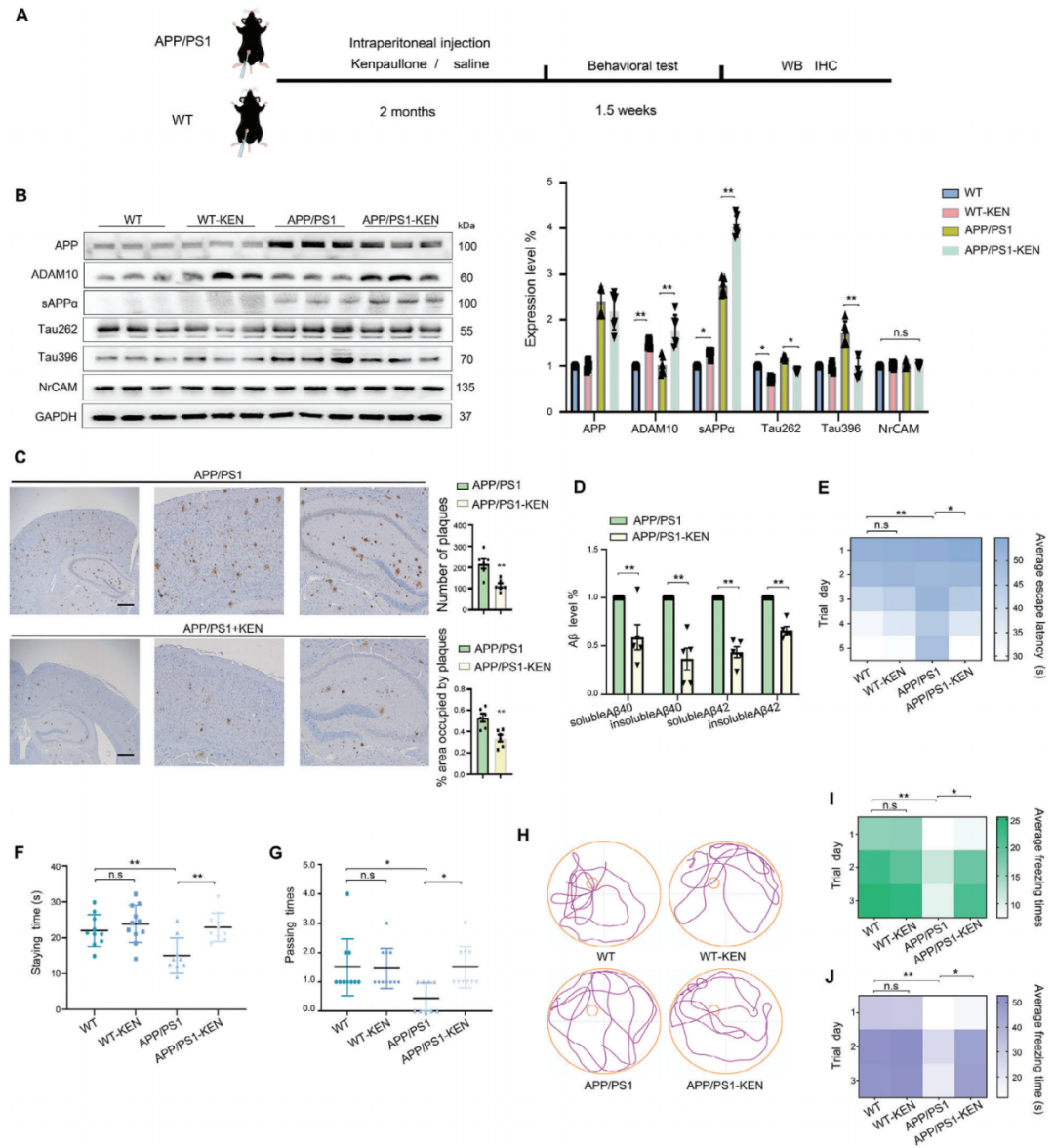
圖3. KEN增強了ADAM10并拯救了APP/PS1小鼠的認知缺陷
04、SHMT2是KEN和5'UTR相互作用RNA結合蛋白的靶基因
為進一步理解KEN誘導的ADAM10翻譯的潛在機制,作者在SH-SY5Y-APP細胞中通過RNA-seq評估了不同調節的基因(DEGs),其中Aβ過度產生,從而在AD樣病理中重塑淀粉樣形成。作者構建了共表達網絡,以找到在有無KEN的情況下基因之間的關系。KEN誘導了共計733個DEGs,包括296個上調和437個下調的基因。上調的通路包括氨基酰-tRNA生物合成、氨基酸生物合成、碳代謝和葉酸一碳池。重要的是,SHMT2被確定為線粒體OCM中的中心基因。5'UTR的依賴性促使作者推測一些DEGs可能也作為RBPs在調節ADAM10翻譯中發揮作用。因此,作者進行了一個RNA結合實驗,其中ADAM10的5'UTR被5-溴尿嘧啶標記。作者發現在控制和KEN的情況下有兩組RBPs。進一步的蛋白質相互作用分析結果顯示,SHMT2與經典的RBPs和核糖體蛋白相互作用。SHMT2與YBX1和CSDE1的相互作用以及5'UTR的進一步驗證,說明了SHMT2是靶向5'UTR的RBP網絡的關鍵組成部分。Western blotting實驗證實,SHMT2蛋白水平受KEN劑量依賴性顯著增加,并且SHMT2敲除阻斷了KEN誘導的ADAM10表達增強。進一步的實驗表明,干擾SHMT2或5'UTR的小分子破壞了KEN誘導的ADAM10翻譯的調節。
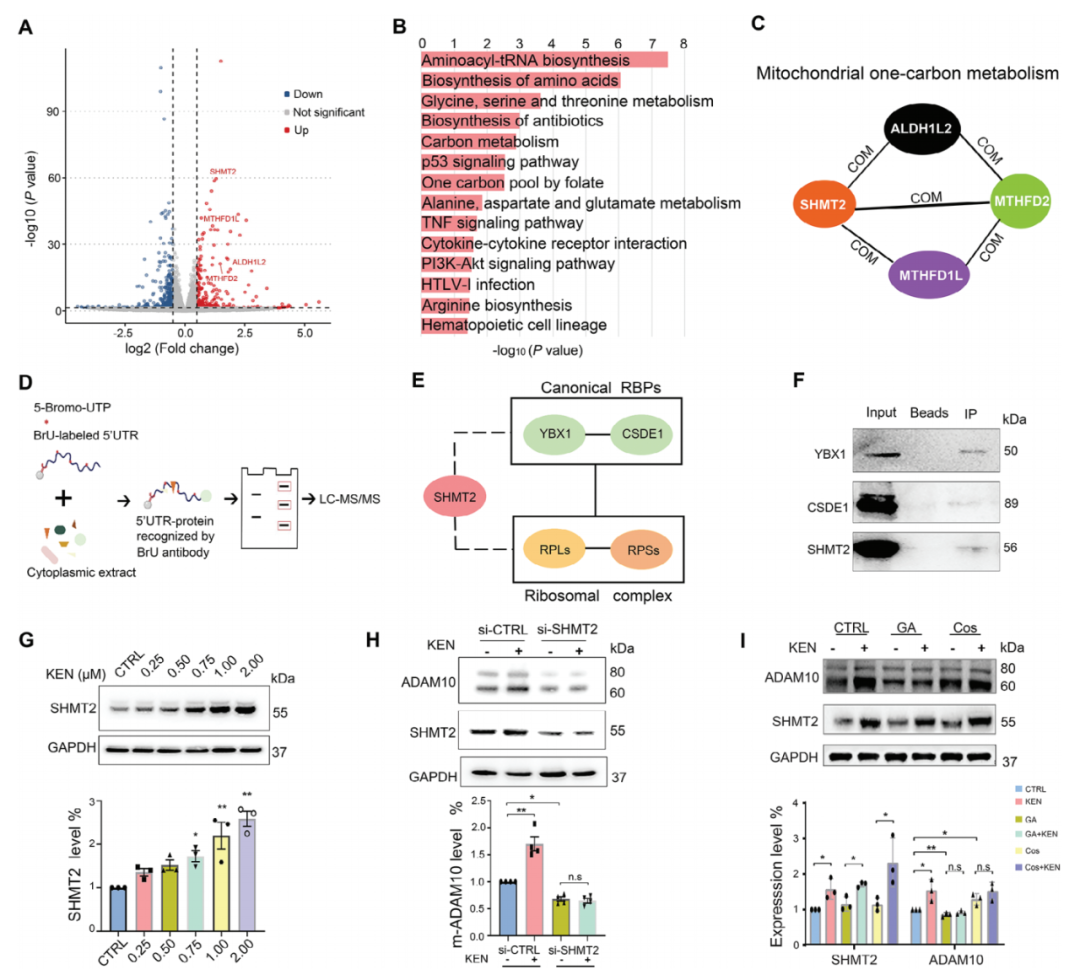
圖4. SHMT2 是 KEN 和與 5′UTR 相互作用的 RBP 的靶基因
05、SHMT2敲除減弱了KEN對APP/PS1小鼠中ADAM10和認知功能的影響
作者接著確定了SHMT2是否也介導了KEN對ADAM10和淀粉樣物質生成的影響。作者在APP/PS1小鼠的海馬區雙側注射病毒AAV載體(對照組)或AAV-shSHMT2,在沒有KEN(AAV-shSHMT2-對照組)和有KEN(AAV-shSHMT2-KEN)的情況下,評估了與Aβ負荷和記憶功能相關的ADAM10蛋白水平。如圖5A所示,SHMT2蛋白水平的顯著降低同時伴隨著ADAM10和sAPP水平的顯著降低;當SHMT2被沉默時,KEN未能有效增強ADAM10/sAPP。此外,SHMT2的沉默顯著增加了海馬區Aβ的數量和強度,以及Aβ40/42水平,而這些變化不受KEN的影響(圖5B、C)。進一步的行為測試顯示,單獨SHMT2的沉默顯著損害了空間和客觀記憶,而額外的KEN未能引起進一步的行為改變(圖5D-K)。這些結果表明,在APP/PS1小鼠中,KEN誘導的對ADAM10、淀粉樣物質生成和認知功能的調控是通過SHMT2介導的。
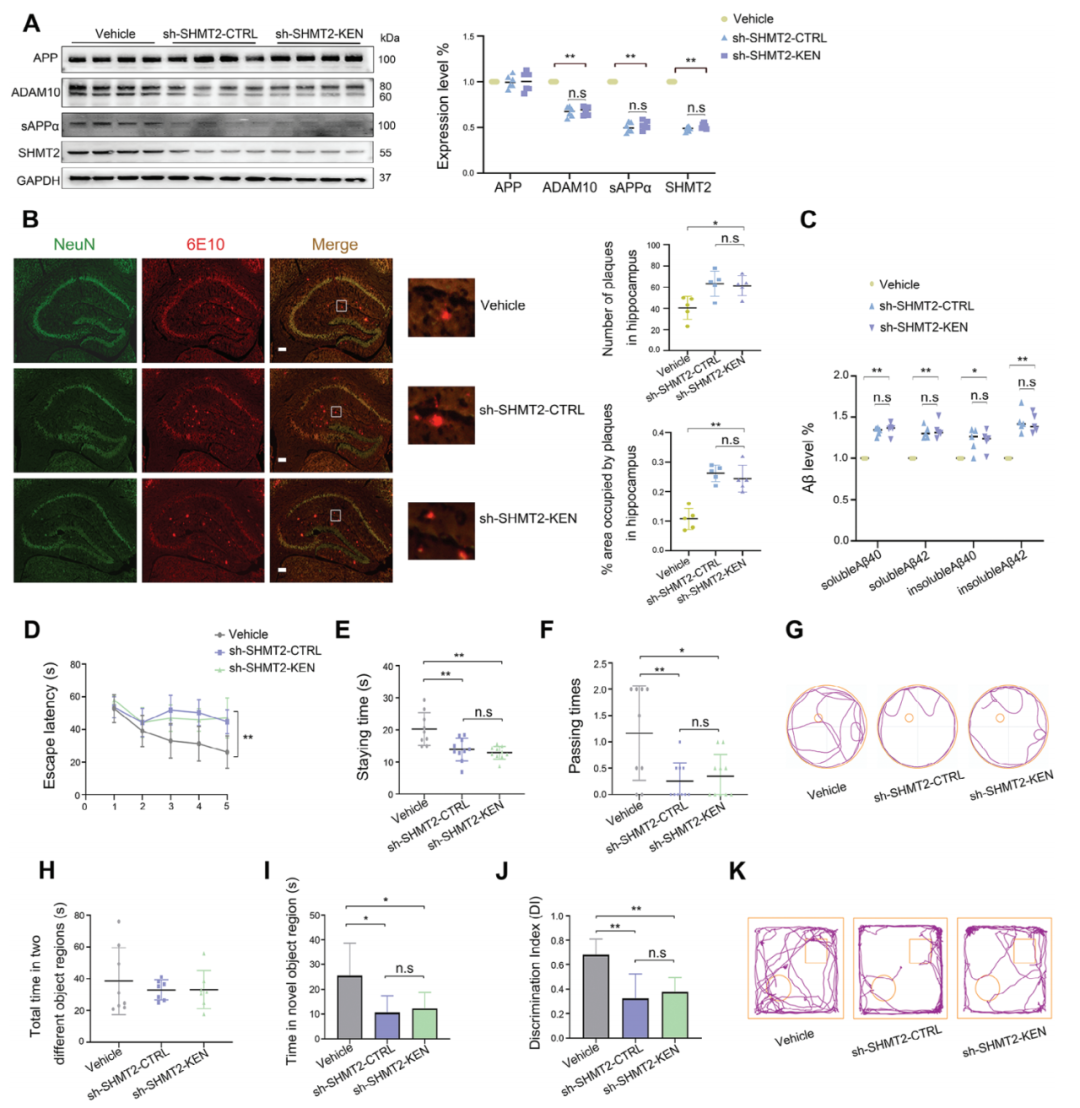
圖5. 敲除 SHMT2 可減輕 KEN 對 ADAM10 和 APP/PS1 小鼠認知功能的影響
06、SHMT2結合了大量與AD和KEN的細胞功能密切相關的RNA
RNA結合特性表明SHMT2除了其酶活性外,還可以通過RNA處理來調節細胞功能。因此,作者在SH-SY5Y細胞中使用針對內源性SHMT2的抗體進行了RIP-seq。如圖6A所示,SHMT2在對照組和KEN處理組中分別招募了6266和6874個轉錄本(補充表RIP-Seq)。利用MEME程序進行的5226個在兩組中常見的RNA的基序分析顯示,SHMT2傾向于與富含GA和GC的基序相互作用(圖6A)。重要的是,兩組中的KEGG通路均包括核糖體、AD以及多種疾病的神經退行性變化(圖6B)。KEN特異性地影響了3401個轉錄本,包括那些僅在對照組或KEN中獨特存在,并且在兩組中都被KEN改變;KEGG分析顯示了代謝途徑和碳代謝與SHMT2功能一致,而其他通路包括RNA轉運也被包括在內(圖6C)。由于RNA-蛋白相互作用調節了RNA處理,作者推測SHMT2靶向的部分RNA可能會對KEN誘導的細胞功能變化發揮作用。利用KEN的DEGs數據(圖4A,B),作者評估了在KEN處理細胞中發生改變的SHMT2靶向mRNA。綜合分析顯示有112個基因重疊(圖6D),GO分析顯示轉錄因子活性和重要的翻譯起始因子活性受到影響,表明SHMT2結合的RNA豐度子集特別受到KEN的調節。這些結果表明,SHMT2通過優先與富含GA/GC的序列相互作用,作為RBP發揮作用,這些序列與AD以及KEN的細胞功能密切相關。
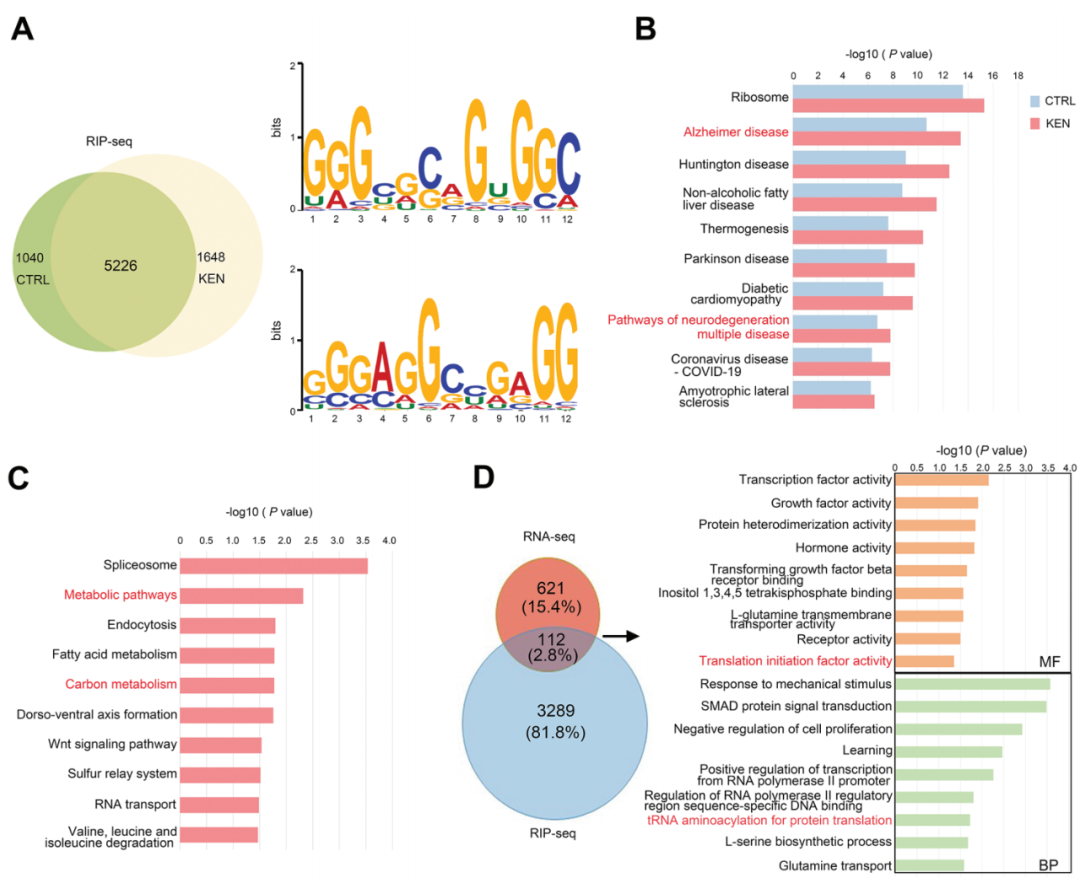
圖6. SHMT2靶向的RNA參與了AD和KEN的細胞功能
07、SHMT2通過直接結合GAGGG基序來控制5′UTR活性
為驗證SHMT2是否直接結合RNA并發揮其功能,作者使用ADAM10 mRNA的5′UTR不同片段進行電泳遷移實驗(EMSA)。如圖7A所示,人類全長5′UTR包含多個GAGGG/GAAAG序列,位置已標示。重組的SHMT2蛋白由小泛素樣修飾物(SUMO)標記,單獨的SUMO不結合任何這些片段(圖7B)。SHMT2僅結合包含GAGGG/GAAAG的片段,分別為69–90、156–175、176–200、201–222和223–244。相反,在RNA片段不包括GAGGG/GAAAG基序時,RNA-蛋白復合物(RPC)缺失(圖7B)。此外,當對應編號的片段中GAGGG/GAAAG基序發生突變時,未發現RPC(圖7C)。作者進一步展示,在100倍過量的非標記RNA存在時,RPC密度顯著降低(圖7D)。由于KEN還增強了小鼠細胞系和原代神經元中的ADAM10表達(圖1),因此作者隨后評估了小鼠來源的SHMT2-5′UTR結合。如圖7E所示,223nt長的小鼠5′UTR(NM_007399)包含多個GAGGG但不含GAAAG基序。SUMO標記的小鼠SHMT2僅結合包含GAGGG的片段1–29和30–57,而不結合不含GAGGG的片段58–86;而單獨的SUMO不結合這些片段。為進一步確認SHMT2是否控制了5′UTR的功能,作者評估了HEK細胞中SHMT2 siRNA的轉染后5′UTR活性。如圖7F所示,SHMT2敲除顯著降低了人類5′UTR的熒光素活性,并顯著減弱了KEN誘導的增強效應。這些結果表明,SHMT2直接結合了人類和小鼠來源的GAGGG基序,并調節了5′UTR的活性。
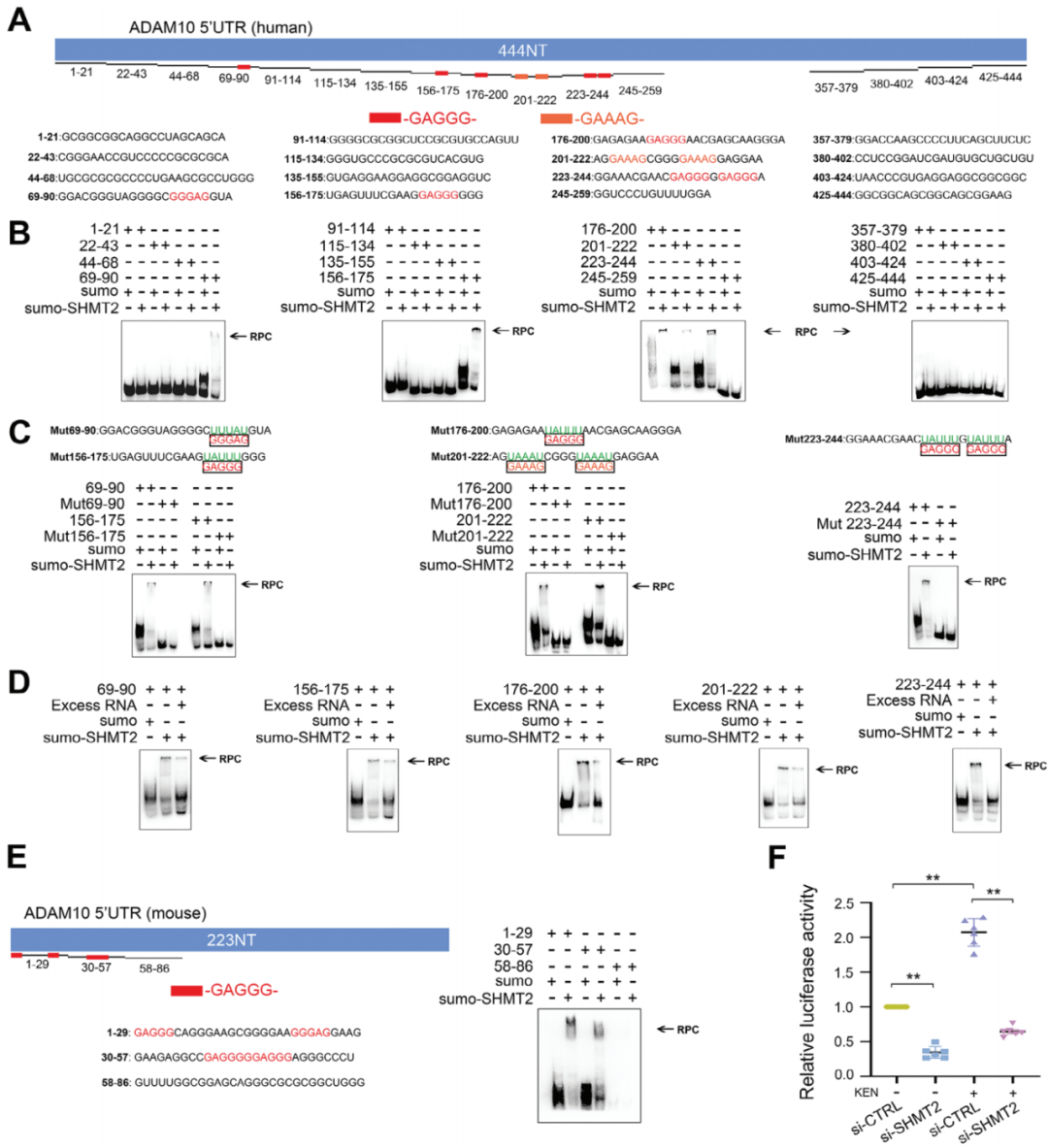
圖7. SHMT2 與 GAGGG 基序結合并控制 5′UTR 活性
08、GAGGG突變影響了eIF2的核糖體掃描
SHMT2偏好于GAGGG模體表明cis元素在調控RNA功能中很重要,尤其是ADAM10的5'UTR活性方面。為了弄清楚GAGGG模體在5'UTR功能中的作用,作者將ADAM10 5'UTR中位于26和56核苷酸處的野生型GAGGG突變為GAUUG(mut-ADAM10 5'UTR),并將其克隆到熒光素報告基因構建中。作者預測了相應的二級結構。相比于對照,mut-ADAM10 5'UTR顯示出了更高的自由能。令人驚訝的是,GAGGG突變(mut-GAGGG)導致5'UTR的熒光素活性顯著增強。作者進一步評估了敲除eIF2S1/2后的5'UTR luciferase活性,結果顯示mut-GAGGG的活性仍然顯著增加,表明GAGGG模體的突變使得RNA結構發生變化,從而增強了核糖體的掃描。綜上所述,GAGGG模體的存在與RNA結構和翻譯效率密切相關,SHMT2與GAGGG模體的結合可能改變RNA結構,促進ADAM10的翻譯,從而減少淀粉樣蛋白生成。
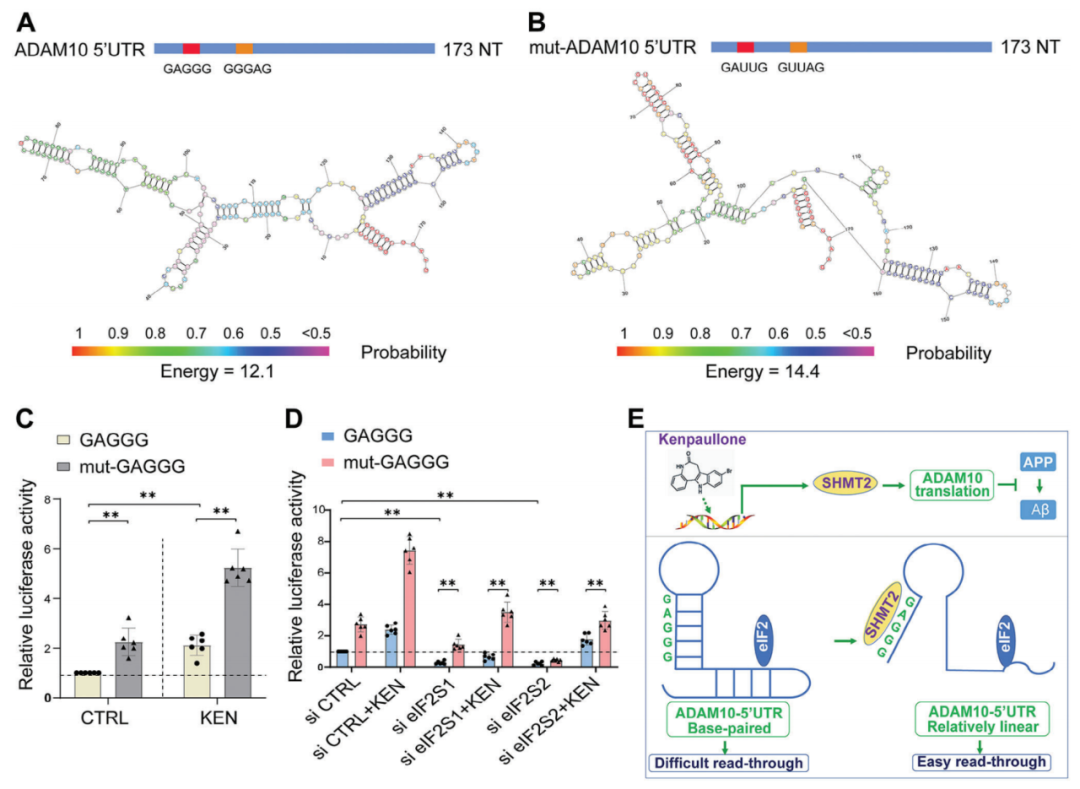
圖8. GAGGG 突變緩解了 eIF2 敲除對 5′UTR 活性的抑制
結論
本研究揭示了SHMT2在調節與AD相關的RNA修飾中的作用,尤其是在KEN對ADAM10 5'UTR活性的影響中的介導作用。然而,SHMT2在調節多種生物學途徑方面的多面作用不支持將KEN-SHMT2的關聯作為治療AD的可能途徑,減少淀粉樣生成只是SHMT2多種效應之一。此外,KEN在動物模型中改善的認知功能也涉及到對Tau病理的減少,這可能與SHMT2無關,因為KEN是已知的GSK和CDK的抑制劑,這些激酶被認為是磷酸化Tau的。SHMT2在AD病理生理學中的詳細功能仍有待進一步澄清。
在本文中,重組SHMT2蛋白由金開瑞生物提供。

最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










