金開(kāi)瑞生物帶您如何合成引物
信息來(lái)源:金開(kāi)瑞 作者:genecreate 發(fā)布時(shí)間:2017-07-19 17:12:27
Oligo DNA的人工化學(xué)合成始于50年代初期,1980年,全自動(dòng)的固相DNA合成儀面市后,使得快速、高效合成Oligo DNA成為可能,這大大地推動(dòng)了生物工程技術(shù)的蓬勃發(fā)展。
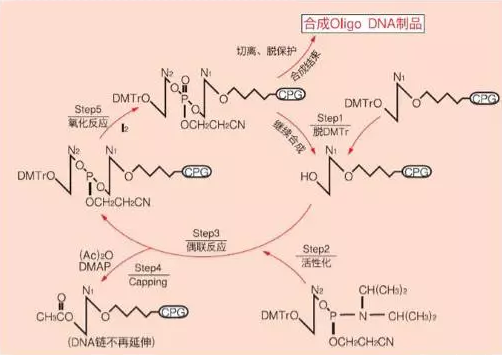
現(xiàn)在一般都采用β-乙腈亞磷酰胺化學(xué)合成Oligo DNA,將DNA固定在固相載體上完成DNA鏈的合成的合成時(shí)從3' →5' 方向進(jìn)行,通常3' 端的第一個(gè)堿基結(jié)合在Glass擔(dān)體 (Controlled Pore Glass,CPG)上。其具有高效、快速的偶聯(lián)以及起始反應(yīng)物比較穩(wěn)定的特點(diǎn)。
引物合成步驟
Step1:脫掉附加在CPG擔(dān)體上的第一個(gè)堿基5' -OH基團(tuán)上的保護(hù)基 (DMTr),準(zhǔn)備附加下一個(gè)新的堿基;
Step2:活化新的堿基單體 (Phosphoramidite),準(zhǔn)備與第一個(gè)堿基進(jìn)行反應(yīng);
Step3:第二個(gè)堿基與第一個(gè)堿基發(fā)生偶聯(lián)反應(yīng);
Step4:將沒(méi)有反應(yīng)的第一個(gè)堿基的5' -OH加帽封死 (Capping),使其不再進(jìn)一步參與反應(yīng);
Step5:將核苷亞磷酸酯氧化成更穩(wěn)定的核苷磷酸酯 (即將三價(jià)磷氧化成五價(jià)磷)。
Step6:重復(fù)進(jìn)行Step1~Step5的循環(huán),直至合成完所需的Oligo DNA序列。
Step7:合成結(jié)束后,將Oligo DNA分子從CPG上切下,再進(jìn)行進(jìn)一步的純化。
現(xiàn)在一般都采用β-乙腈亞磷酰胺化學(xué)合成Oligo DNA,將DNA固定在固相載體上完成DNA鏈的合成的合成時(shí)從3' →5' 方向進(jìn)行,通常3' 端的第一個(gè)堿基結(jié)合在Glass擔(dān)體 (Controlled Pore Glass,CPG)上。其具有高效、快速的偶聯(lián)以及起始反應(yīng)物比較穩(wěn)定的特點(diǎn)。
引物合成步驟
Step1:脫掉附加在CPG擔(dān)體上的第一個(gè)堿基5' -OH基團(tuán)上的保護(hù)基 (DMTr),準(zhǔn)備附加下一個(gè)新的堿基;
Step2:活化新的堿基單體 (Phosphoramidite),準(zhǔn)備與第一個(gè)堿基進(jìn)行反應(yīng);
Step3:第二個(gè)堿基與第一個(gè)堿基發(fā)生偶聯(lián)反應(yīng);
Step4:將沒(méi)有反應(yīng)的第一個(gè)堿基的5' -OH加帽封死 (Capping),使其不再進(jìn)一步參與反應(yīng);
Step5:將核苷亞磷酸酯氧化成更穩(wěn)定的核苷磷酸酯 (即將三價(jià)磷氧化成五價(jià)磷)。
Step6:重復(fù)進(jìn)行Step1~Step5的循環(huán),直至合成完所需的Oligo DNA序列。
Step7:合成結(jié)束后,將Oligo DNA分子從CPG上切下,再進(jìn)行進(jìn)一步的純化。
OD數(shù)的確定
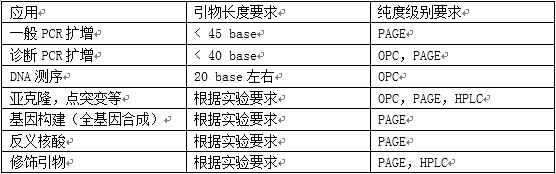
一般PCR擴(kuò)增,2 OD引物,可以做200-500次50ul標(biāo)準(zhǔn)PCR反應(yīng)。如果是做基因拼接或退火后做連接,1 OD就足夠了。但是有些研究人員,就做幾次PCR,但是卻要5-10 OD。做全基因構(gòu)建的引物都比較長(zhǎng),但是我們有些研究人員也要求高OD數(shù)。片段越長(zhǎng), 最后全長(zhǎng)得率就越低,出錯(cuò)的幾率就越大。超出需要之外的OD數(shù)要求,也是一種浪費(fèi)。
引物純度檢測(cè)
實(shí)驗(yàn)室方便的作法是用PAGE方法。使用加有7M尿素的16%的聚丙烯酰胺凝膠進(jìn)行電泳。取0.2-0.5OD的引物,用尿素飽和液溶解或引物溶液中加入尿素干粉直到飽和,上樣前加熱變性(95℃,2mins)。加入尿素的目的一是變性,二是增加樣品比重,容易加樣。600V電壓進(jìn)行電泳,一定時(shí)間后(約2-3小時(shí)),剝膠,用熒光TLC板在紫外燈下檢測(cè)帶型,在主帶之下沒(méi)有雜帶,說(shuō)明純度是好的。如果條件許可,也可以用EB 染色或銀染方式染色。
引物級(jí)別選擇
一般PCR擴(kuò)增,2 OD引物,可以做200-500次50ul標(biāo)準(zhǔn)PCR反應(yīng)。如果是做基因拼接或退火后做連接,1 OD就足夠了。但是有些研究人員,就做幾次PCR,但是卻要5-10 OD。做全基因構(gòu)建的引物都比較長(zhǎng),但是我們有些研究人員也要求高OD數(shù)。片段越長(zhǎng), 最后全長(zhǎng)得率就越低,出錯(cuò)的幾率就越大。超出需要之外的OD數(shù)要求,也是一種浪費(fèi)。
引物純度檢測(cè)
實(shí)驗(yàn)室方便的作法是用PAGE方法。使用加有7M尿素的16%的聚丙烯酰胺凝膠進(jìn)行電泳。取0.2-0.5OD的引物,用尿素飽和液溶解或引物溶液中加入尿素干粉直到飽和,上樣前加熱變性(95℃,2mins)。加入尿素的目的一是變性,二是增加樣品比重,容易加樣。600V電壓進(jìn)行電泳,一定時(shí)間后(約2-3小時(shí)),剝膠,用熒光TLC板在紫外燈下檢測(cè)帶型,在主帶之下沒(méi)有雜帶,說(shuō)明純度是好的。如果條件許可,也可以用EB 染色或銀染方式染色。
引物級(jí)別選擇
上一條:PCR那點(diǎn)事
下一條:外源蛋白—大腸桿菌里的不速之客
最新動(dòng)態(tài)
-
09.23
中藥的現(xiàn)代詮釋?zhuān)和饷隗w如何革新傳統(tǒng)醫(yī)學(xué)?
-
07.02
1+1>2!深度解析RNA測(cè)序數(shù)據(jù)挖掘邏輯和后期實(shí)驗(yàn)設(shè)計(jì)思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤(pán)點(diǎn)近期水稻研究的重大突破
-
06.28
科學(xué)與美學(xué)的結(jié)合體:植物亞細(xì)胞定位技術(shù)詳解
-
06.28
“聚焦新質(zhì)生產(chǎn)力,激發(fā)科研新動(dòng)能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無(wú)不“研”|一文讀懂免疫共沉淀技術(shù)(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準(zhǔn)、直觀、實(shí)時(shí)——取經(jīng)“蛋白互作研究翹楚”BIFC!
-
05.14
轉(zhuǎn)染效率低、干擾效果差、重復(fù)性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術(shù)核心要點(diǎn),讓“emsa” 秒變“easy”
找回密碼
注冊(cè)帳號(hào)
-
 在線客服
在線客服 -

 在線訂購(gòu)
在線訂購(gòu) -

 掃碼領(lǐng)資料
掃碼領(lǐng)資料掃碼領(lǐng)資料

電話:19522948401
-

 文獻(xiàn)獎(jiǎng)勵(lì)申請(qǐng)
文獻(xiàn)獎(jiǎng)勵(lì)申請(qǐng)


