抗體純化方法有哪些?
信息來源:金開瑞 作者:genecreate 發布時間:2017-09-12 10:51:42
抗體制備出來之后,需要進一步純化得到純的多抗或單抗,既有利于保存也有利于排除雜蛋白對結果的影響。常規用于純化的材料是腹水和細胞培養上清,而通常經過免疫制備的抗體大多數是IgG的各種亞型,以及少數是IgM,二者電泳條帶分步大致如下:

硫酸銨沉淀法
基本原理:高濃度的硫酸銨通過與球蛋白競爭水分子破壞蛋白表明的水化膜,降低球蛋白的溶解性,是分離免疫球蛋白的常用方法,而且不同的免疫球蛋白適宜的硫酸銨濃度也稍有差別,一般用來分離抗體的硫酸銨飽和度在33~50%。
適用于:鼠抗所有亞類、其他種屬抗體、任何種屬的IgM、IgG、IgA
基本操作:
1.過濾、離心腹水或者培養上清得上清;
2.加入飽和硫酸銨至終濃度45%,靜置沉淀蛋白;
3.沉淀蛋白用最小體積PBS或硼酸鹽緩沖液溶解,用PBS或硼酸鹽緩沖液透析除鹽;
4.過聚丙烯酰胺葡聚糖凝膠柱,PBS或硼酸鹽(含0.02%疊氮鈉)緩沖液洗脫;
5.電泳檢測分子量大小,分光光度法測定抗體濃度;
6.抗體保存濃度在0.1-30 mg/mL適宜,-20 ℃保存不超過一個月,避免反復凍融。
親和層析法
基本原理:基因工程改造的protein A和protein G能特異性結合哺乳動物IgG的Fc區段,將protein A和protein G結合到柱料上,通過親和層析的方式,可將IgG及其亞類與片段純化出來。
成員介紹:protein A分離自Staphylococcus aureus的細胞壁,分子量42 kDa,由spa基因編碼,具有五個同型的免疫球蛋白結合結構域,每個結構域由三個α螺旋構成。
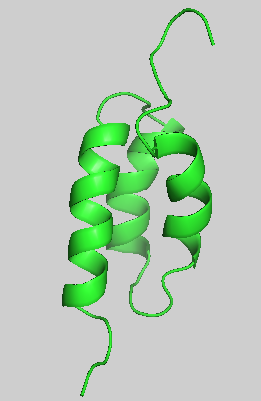
protein A的B結構域
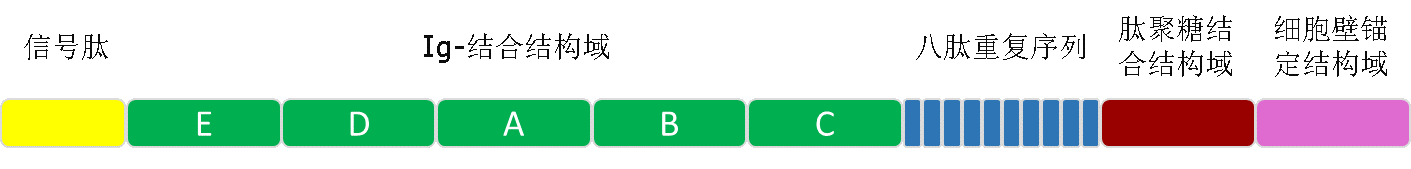
protein A的各個結構域
protein A可結合多數免疫球蛋白的Fc段(尤其是人的IgG1、IgG2、IgG4,豚鼠,獼猴,鼠類IgG2a、兔)以及人VH3家族的Fab段。基因工程改造的protein A通常使用大腸桿菌作為表達宿主,表達產物仍含有五個Fc結合結構域。對其結構上的改造主要是為了增加與多孔性材料的偶聯性能,也有的改造protein A含有四個或六個同型Fc結合結構域,另外結構域數目較少的protein A能得到更好的抗體純化效果。
protein G分離自G Streptococcus的細胞壁,分子量65 kDa,由spg基因編碼,可結合抗體的Fc段、Fab段以及血清中的白蛋白。基因工程改造的protein G去掉了與白蛋白的結合位點僅僅保留Fc結合結構域,其結合力較protein A更強。

protein G的B結構域

protein G的各個結構域
還有一種protein A/G蛋白,是基因工程改造產物,是將protein A的4個Fc結合結構域與protein G的2個Fc結合結構域融合表達得到的。protein A/G結合了二者的特性,能結合人和鼠的IgG所有亞型,不結合鼠的IgA、IgM。
①protein A親和層析
適用于:人(IgG3除外)、兔、豚鼠、豬的抗體;
基本操作:
1.過濾、離心腹水或者培養上清得上清;
2.調節pH到8.0:腹水以10倍體積pH8.0 PBS稀釋、培養上清用pH8.0 PBS透析或強氧化鈉調節;
3.過protein A瓊脂糖凝膠柱,pH8.0 PBS洗雜;
4.檸檬酸緩沖液洗脫抗體(小鼠IgG1用pH6.5,IgG2a用pH4.5,IgG2b和IgG3用pH3.0),并注意收集管內需加入Tris緩沖液中和滴下的抗體溶液;
5.用PBS透析;
6.電泳檢測分子量大小,分光光度法測定抗體濃度。
②protein G親和層析
與protein A相比,protein G通常情況下在低pH環境下與抗體結合力較強,不過高pH環境下小鼠IgG1和兔、人的抗體在仍可以與protein G結合。
適用于:小鼠IgG1、大鼠抗體、猴抗體、兔抗體、牛抗體、山羊抗體、馬抗體、綿羊抗體;
基本操作:
1.過濾、離心腹水或者培養上清得上清;
2.調節pH到5.0:腹水以10倍體積0.1 M醋酸鈉(pH5.0)稀釋、培養上清以2倍體積0.1 M醋酸鈉(pH5.0)稀釋;
3.過protein G柱,0.1 M醋酸鈉(pH5.0)洗雜;
4.0.1 M甘氨酸(pH2.8)洗脫抗體,并注意收集管內需加入Tris緩沖液中和滴下的抗體溶液
5.用PBS透析;
6.電泳檢測分子量大小,分光光度法測定抗體濃度。
③抗原親和層析法
抗原親和純化一般用在多抗的純化上,這種純化方式去掉了血清中那些非特異性結合的抗體分子,得到的抗體分子基本上都是能特異性與抗原結合的。抗原親和純化需要先將抗原偶聯到柱料上,然后通過親和層析的方式去除非特異性抗體及雜蛋白,得到特異性抗體。通常采用的柱料為溴化氫預處理和N-羥基琥珀酰亞胺預處理瓊脂糖凝膠柱料,前者適合偶聯大分子,后者適合偶聯小分子物質,在實際操作中還是需要根據情況進行選擇。
適用于:多抗抗體的純化,對抗體亞型無限制
偶聯基本操作:
1.抗原用0.1 M NaHCO3偶聯緩沖液(含0.5 M NaCl,pH8.3)溶解;
2.用1 mM稀鹽酸洗滌柱料;
3.混合抗原和柱料,在室溫混懸1 h或者4 ℃混懸過夜;
4.用偶聯緩沖液洗滌偶聯的柱料去掉未偶聯抗原;
5.用0.1 M Tris(pH8.0)或1 M乙醇胺(pH8.0)處理偶聯柱料2 h以封閉未偶聯位點;
6.依次用0.1 M醋酸鈉緩沖液(含0.5 M NaCl,pH4.0)和0.1 M Tris(含0.5 M NaCl,pH8.0)洗滌偶聯柱料五次,重復此操作三遍。
純化基本操作:
1.過濾、離心腹水或者培養上清得上清;
2.0.01 M PBS(pH7.4)平衡偶聯柱料;
3.抗體樣品過柱,0.01 M PBS(pH7.4)洗雜;
4.抗體洗脫液洗脫抗體;
5.用0.01 M PBS(pH7.4)透析;
6.電泳檢測分子量大小,分光光度法測定抗體濃度。
隨著技術的發展抗體的純化方法越來越多,例如分子篩層析、離子交換層析等技術也被用于抗體的純化,在實際運用中需要根據實驗目的及其他因素進行方法的選擇。
下一條:實驗心得:免疫共沉淀的步驟
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










