研究蛋白-蛋白互作方法—親和純化結(jié)合SWATH(AP-SWATH)
信息來源:金開瑞 作者:genecreate 發(fā)布時(shí)間:2017-12-14 16:21:46
經(jīng)典文獻(xiàn)解讀:利用SWATH質(zhì)譜技術(shù)研究原代細(xì)胞信號(hào)復(fù)合體的精確時(shí)間圖譜
蛋白間相互作用是細(xì)胞各種基本功能的主要完成者,參與幾乎所有的重要生命活動(dòng)。因此,蛋白-蛋白相互作用研究以及建立相互作用的關(guān)系網(wǎng)絡(luò)圖,具有十分重要的意義,也是目前蛋白質(zhì)研究領(lǐng)域的熱點(diǎn)。
親和純化結(jié)合SWATH(AP-SWATH)技術(shù)是近幾年發(fā)展起來的研究蛋白相互作用的一種重要技術(shù),該技術(shù)能夠高特異性的準(zhǔn)確富集到靶蛋白的特異性相互作用蛋白,并實(shí)現(xiàn)復(fù)合蛋白質(zhì)的準(zhǔn)確鑒定和定量。
下面就來818如何通過AP-SWATH技術(shù)來開展蛋白互作研究之旅!
基本信息
題目:Precise Temporal Profiling of Signaling Complexes in Primary Cells Using SWATH Mass Spectrometry(利用SWATH質(zhì)譜技術(shù)研究原代細(xì)胞信號(hào)復(fù)合體的精確時(shí)間圖譜)
期刊:Cell Reports
影響因子:8.281
主要技術(shù):AP-SWATH
研究背景
信號(hào)通路中蛋白質(zhì)-蛋白質(zhì)相互作用的動(dòng)態(tài)組織過程是協(xié)調(diào)細(xì)胞功能以響應(yīng)外在和內(nèi)在信號(hào)的關(guān)鍵。親和純化聯(lián)合質(zhì)譜技術(shù)(AP-MS)一直是各種模型系統(tǒng)中研究蛋白質(zhì)-蛋白質(zhì)相互作用鑒定和蛋白質(zhì)復(fù)合物鑒定的方法。生長因子受體結(jié)合蛋白2(GRB2)是由1個(gè)SH2結(jié)構(gòu)域和2個(gè)SH3結(jié)構(gòu)域構(gòu)成的必需接頭蛋白,其參與調(diào)節(jié)MAPK信號(hào)通路。在T淋巴細(xì)胞中,GRB2也是TCR信號(hào)通路網(wǎng)絡(luò)中的一部分,其不僅能夠調(diào)控T細(xì)胞的發(fā)育,而且能促成成熟T細(xì)胞的活化。鑒于GRB2在信號(hào)啟動(dòng)和多樣化中的重要作用,在不同的信號(hào)級(jí)聯(lián)和細(xì)胞類型中形成的信號(hào)復(fù)合體的組成和動(dòng)力學(xué)是理解其實(shí)際功能范圍的關(guān)鍵。因此,作者選擇GRB2作為評估swath- ms的模型,可以在兩種原始細(xì)胞中快速、可靠、準(zhǔn)確地定量分析蛋白質(zhì)相互作用動(dòng)力學(xué)(圖1)
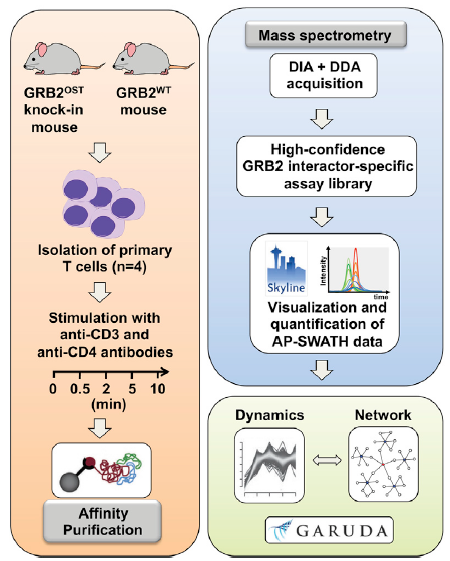
圖1 AP-SWATH工作流程圖——描繪原始T細(xì)胞中GRB2相互作用蛋白的組成和動(dòng)力學(xué)
研究內(nèi)容及結(jié)果
1. 繪制外周CD4 + T細(xì)胞中GRB2的相互作用圖譜
作者利用AP-SWATH鑒定了在TCR介導(dǎo)的原代小鼠T細(xì)胞激活之前或之后與GRB2相互作用的蛋白質(zhì)。經(jīng)分析,獲得658 個(gè)蛋白(FDR<1%),其中53個(gè)是具有高可信度的GRB2相互作用蛋白(圖2)。
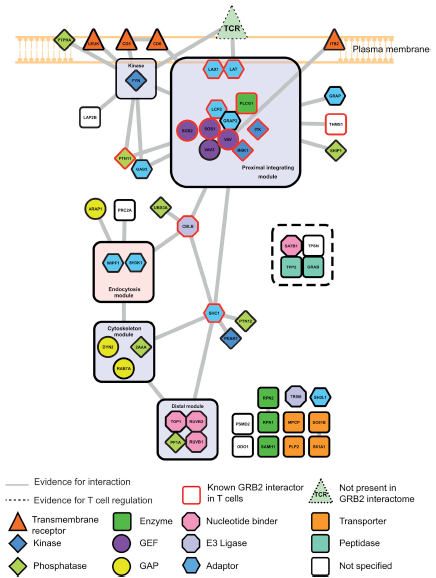
圖2 外周CD4 + T細(xì)胞中GRB2蛋白的相互作用蛋白
2. 外周CD4 + T細(xì)胞中GRB2的蛋白質(zhì)相互作用組的可重復(fù)定量測定
從原代細(xì)胞產(chǎn)生高度精確和可重復(fù)的AP-SWATH數(shù)據(jù)對于理解生理層面的動(dòng)態(tài)復(fù)合物形成至關(guān)重要。本文作者評估了AP-SWATH分析技術(shù)的重現(xiàn)性,以量化TCR介導(dǎo)的T細(xì)胞活化0.5min,2min,5min和10min后GRB2蛋白相互作用組的動(dòng)力學(xué)變化。AP-SWATH的目標(biāo)分析數(shù)據(jù)是由之前鑒定的604個(gè)肽段和4020 GRB2特異轉(zhuǎn)換體和53個(gè)高可信度的GRB2相互作用因子組成。這53個(gè)蛋白質(zhì)在整個(gè)時(shí)間序列中同時(shí)進(jìn)行量化(圖3A), 例如,在T細(xì)胞刺激前后,在所有四個(gè)生物重復(fù)中,中值系數(shù)變異(CV)范圍為19.7%~33.2%,與使用轉(zhuǎn)化細(xì)胞系進(jìn)行的AP-SWATH研究計(jì)算得到的CV值相似(圖3C)。值得注意的是,使用30分鐘的短液相色譜(LC)梯度對于高度可重現(xiàn)和準(zhǔn)確的定量不會(huì)產(chǎn)生影響,從而能夠提高時(shí)間效應(yīng)實(shí)驗(yàn)的通量。因此,可以通過原代小鼠CD4 + T細(xì)胞來實(shí)現(xiàn)高可信度、高時(shí)間分辨的GRB2蛋白相互作用蛋白的鑒定和定量。
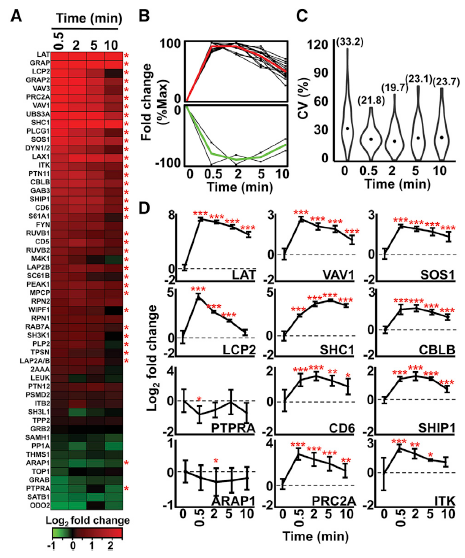
圖3精確和重復(fù)定量外周CD4 + T細(xì)胞中GRB2的相互作用蛋白
3. 對外周CD4+ T細(xì)胞中時(shí)間分辨GRB2蛋白相互作用的透徹分析
作者利用兩個(gè)開源軟件系統(tǒng)分析了AP-SWATH數(shù)據(jù):用于原始數(shù)據(jù)分析的Skyline中的圖形用戶界面MSstats和用于進(jìn)一步數(shù)據(jù)處理和可視化的Garuda平臺(tái),這兩個(gè)系統(tǒng)都都支持統(tǒng)計(jì)學(xué)和計(jì)算分析的重現(xiàn)性。利用這些軟件工具,生成了熱圖、蛋白質(zhì)簇和統(tǒng)計(jì)數(shù)據(jù),證明了在T細(xì)胞激活的最初幾秒內(nèi),GRB2周圍形成了復(fù)雜的蛋白質(zhì)組合(圖3A,3B)。
4. 發(fā)育中的T細(xì)胞和成熟T細(xì)胞的GRB2相互作用蛋白存在特定的動(dòng)力學(xué)差異
作者接下來測定了抗CD3和抗CD4抗體活化后的發(fā)育中的T細(xì)胞和成熟T細(xì)胞之間的GRB2相互作用蛋白動(dòng)力學(xué),觀察其是否存在差異。在構(gòu)成GRB2相互作用的蛋白質(zhì)中,在發(fā)育和成熟T細(xì)胞中能同時(shí)檢測到14個(gè)GRB2相互作用因子,因此可用于整個(gè)動(dòng)力學(xué)的比較分析(圖4)。結(jié)果發(fā)現(xiàn),在14個(gè)GRB2相互作用因子中,有6個(gè)在發(fā)育和成熟T細(xì)胞之間觀察到相似的時(shí)間分辨特征(LAT,GRAP,MPCP,PRC2A,SHC1,和THMS1)(圖4)。相反,ARAP1、GRAP2、M4K1、PTPRA、SATB1、SHIP1、SOS1、USB3A在發(fā)育和成熟T細(xì)胞間至少有一個(gè)刺激時(shí)間點(diǎn)之間存在顯著的動(dòng)力學(xué)差異(圖4)。
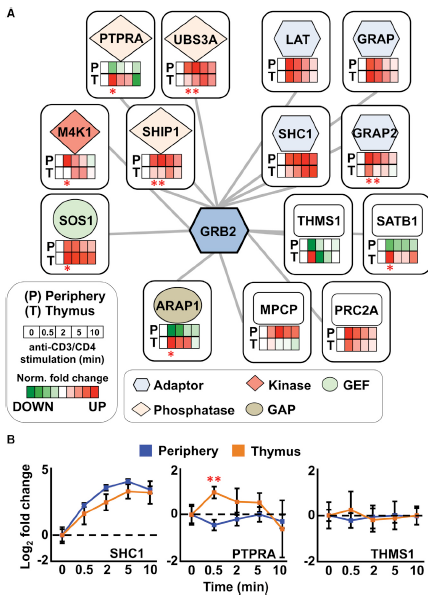
圖4 比較定量發(fā)育中的和成熟的原代T細(xì)胞的GRB2蛋白復(fù)合物動(dòng)力學(xué)差異
文章小結(jié)
蛋白質(zhì)-蛋白質(zhì)相互作用的特異性和動(dòng)態(tài)形成是調(diào)節(jié)細(xì)胞信號(hào)傳導(dǎo)的關(guān)鍵機(jī)制。然而在公共蛋白相互作用數(shù)據(jù)的基礎(chǔ)上,正確建立能夠反映原代細(xì)胞信號(hào)系統(tǒng)的通路模型,受系統(tǒng)檢索蛋白相互作用數(shù)據(jù)的方法缺陷影響。該文章引入了AP-SWATH的工作流程來克服這些缺點(diǎn)。文中的結(jié)論可以證明所提出的方法具有足夠的精確性和穩(wěn)定性,以準(zhǔn)確地探測信號(hào)復(fù)合物的形成。另外,本文介紹的方法流程可以廣泛地應(yīng)用于各種細(xì)胞和組織類型的蛋白相互作用關(guān)系的鑒定。
文獻(xiàn)來源
Caron E, Roncagalli R, Hase T, et al. Precise Temporal Profiling of Signaling Complexes in Primary Cells Using SWATH Mass Spectrometry.[J]. Cell Reports, 2017, 18(13):3219.
小編告訴您,金開瑞借助高精度質(zhì)譜平臺(tái),結(jié)合親和純化與Label-free、SILAC或SWATH定量技術(shù),開發(fā)了一系列靈活的互作蛋白質(zhì)組研究策略。目前熱門的AP-SWATH流程,靈敏度高、重復(fù)性好,非常適合蛋白質(zhì)相互作用的研究。
最新動(dòng)態(tài)
-
09.23
中藥的現(xiàn)代詮釋:外泌體如何革新傳統(tǒng)醫(yī)學(xué)?
-
07.02
1+1>2!深度解析RNA測序數(shù)據(jù)挖掘邏輯和后期實(shí)驗(yàn)設(shè)計(jì)思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點(diǎn)近期水稻研究的重大突破
-
06.28
科學(xué)與美學(xué)的結(jié)合體:植物亞細(xì)胞定位技術(shù)詳解
-
06.28
“聚焦新質(zhì)生產(chǎn)力,激發(fā)科研新動(dòng)能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(shù)(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準(zhǔn)、直觀、實(shí)時(shí)——取經(jīng)“蛋白互作研究翹楚”BIFC!
-
05.14
轉(zhuǎn)染效率低、干擾效果差、重復(fù)性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術(shù)核心要點(diǎn),讓“emsa” 秒變“easy”
找回密碼
注冊帳號(hào)
-
 在線客服
在線客服 -

 在線訂購
在線訂購 -

 掃碼領(lǐng)資料
掃碼領(lǐng)資料掃碼領(lǐng)資料

電話:19522948401
-

 文獻(xiàn)獎(jiǎng)勵(lì)申請
文獻(xiàn)獎(jiǎng)勵(lì)申請


