外泌體—藥物靶向治療利器
信息來源:金開瑞 作者:genecreate 發布時間:2018-05-08 11:55:36
1.外泌體簡介
外泌體 (exosomes) 是一種機體內大多數細胞分泌的微小囊泡,直徑約為30 ~ 150 nm,具脂質雙層膜,其形成機制非常簡單,簡而言之: “內吞-融合-外排”,如圖所示,毫無違和感(圖1a)。從1980年首次發現外泌體至今,已有30多年的歷史,最初被認為是細胞的“垃圾”,是細胞排泄廢物的一種方式;2013年,科學家們發現細胞囊泡運輸的調節機制,獲得當年諾貝爾生理學或醫學獎,開啟了外泌體研究的新時代,此外,外泌體和微囊泡(圖1b)、凋亡小體(圖1c)明顯不同,有鮮明的特點和潛在價值,時至今日,已逐步成為科研熱點(圖2)。
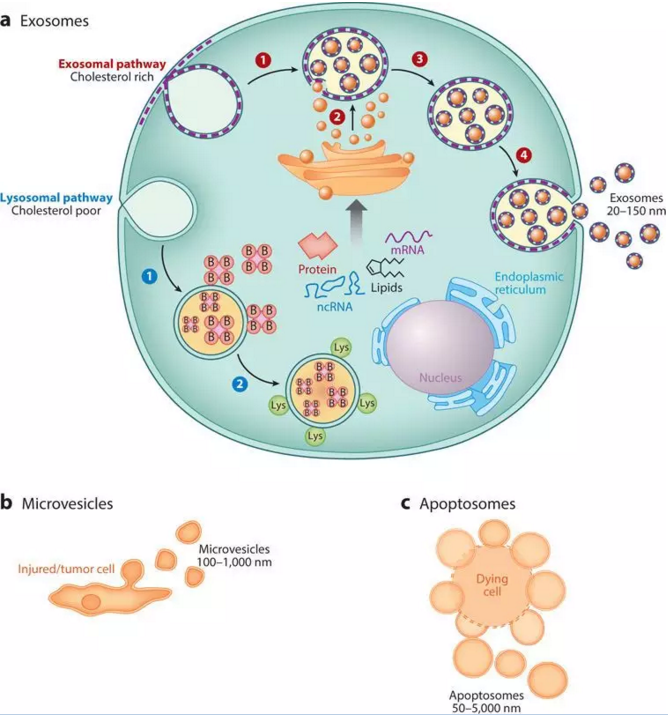
圖1
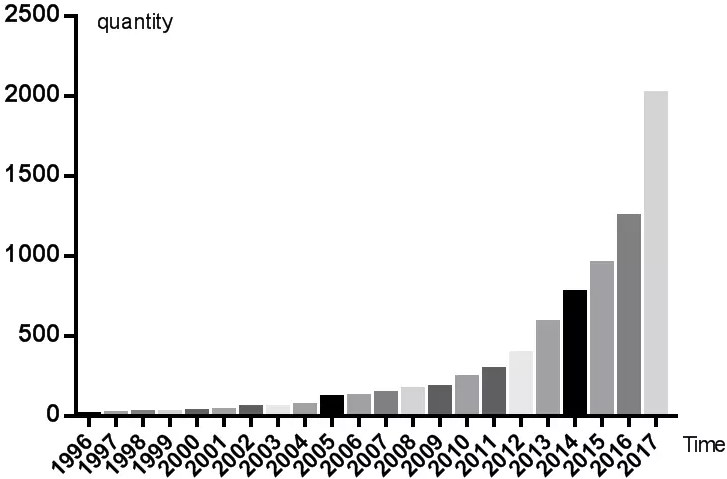
圖2
2.外泌體作為藥物載體的優勢
對于普通藥物而言,通常在進入體內后僅有極少一部分才能夠真正作用于病變部位。這是制約藥物療效,并導致藥物毒副作用的根本原因。獲取具有像導彈一樣精準靶向能力的藥物是人類的一個夢想,也是藥物開發的終極目標。隨著藥物研發進入靶向時代,越來越多的靶向藥物成功上市,其中藥物載體的設計研發愈發重要。外泌體,作為天然的胞間信息載體,以其相對較小的分子結構,天然分子轉運特性及良好的生物相容性,在藥物載體領域存在巨大應用潛力。
較之現有的藥物載體(如人工制造的脂質體), 外泌體有其顯著的優越性:
(1)不同來源外泌體表面分子不一, 對受體細胞有選擇性, 治療上更有利;
(2)相對脂質體對親水性物質較低的包裝效率, 外泌體顯著提高包裝效率;
(3)特殊細胞[如未成熟的DC細胞或充間質干細胞]中的外泌體, 由于特殊的表 面分子,可避免與抗體、凝血因子等產生作用, 避免體內產生免疫反應。
盡管近年來在siRNA胞內遞送方面取得較大進展,但針對特定組織或細胞類型靶向遞送,同時避免非特異性遞送,特別是對肝臟仍然具有挑戰性;其二,siRNA或遞送載體的免疫原性也是一個主要障礙。而天然存在的RNA載體,如外泌體,可能會提供一個尚未開發的有效傳遞策略來源。有研究表明,經過人工設計的外泌體可以通過小鼠的血腦屏障發揮作用(圖3)。
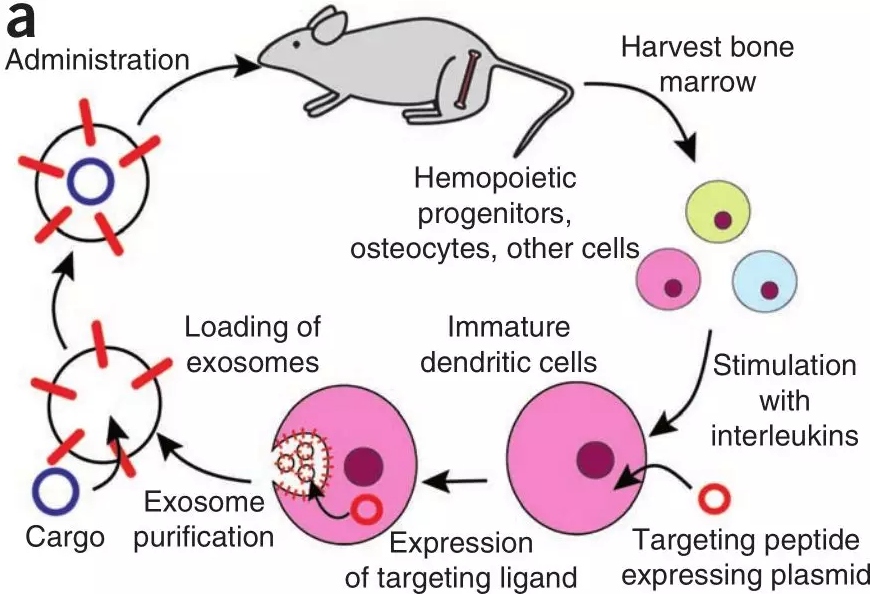
圖3
3.外泌體作為藥物載體上的應用
外泌體攜帶和傳遞重要的信號分子,形成了一種全新的細胞間信息傳遞系統,影響細胞的生理狀態并與多種疾病的發生與進程密切相關,外泌體可裝載的藥物類型包括小分子化學藥物、蛋白質和肽、核酸藥物等(圖4)。對于外泌體作為藥物載體的選擇遵循兩大基本原則:
1、 保持內含藥物在體內環境中的活性;
2、 在不引發機體對藥物載體產生免疫反應的情況下釋放內含物。
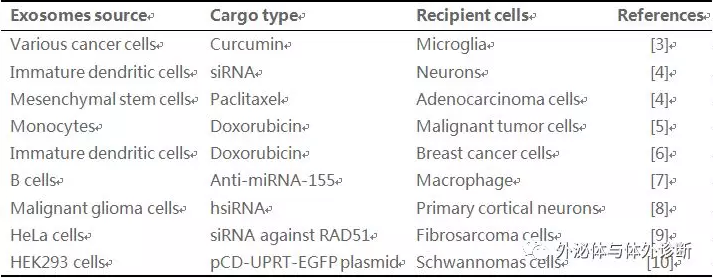
目前已有多篇文獻報道外泌體在藥物載體上的應用(表1):
Table 1 Exosomes applied as drug carrier
外泌體作為藥物載體上的應用方向(圖4):
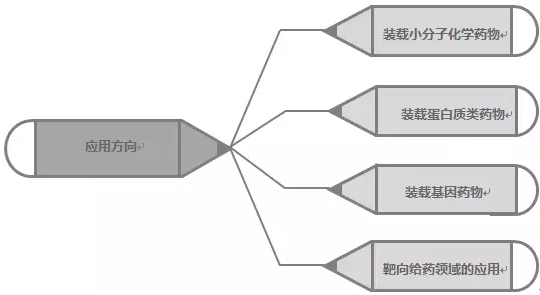
圖4
應用案例1:
Extracellular vesicles are the Trojan horses of viral infection. 細胞外囊泡是病毒感染的特洛伊木馬。PMID:27232382
Altan-Bonnet [11]發現, 病毒宿主細胞產生的外泌體通過包裹病毒基因組及病毒顆粒運送至新的易染宿主細胞中實現病毒傳播, 圖4顯示了胞外囊泡介導病毒體和病毒核酸種群在兩個細胞間非裂解性傳輸的機制。該過程成為病毒擴散的新途徑,進一步闡述了外泌體可應用于藥物載體方面的理論 (圖5)。
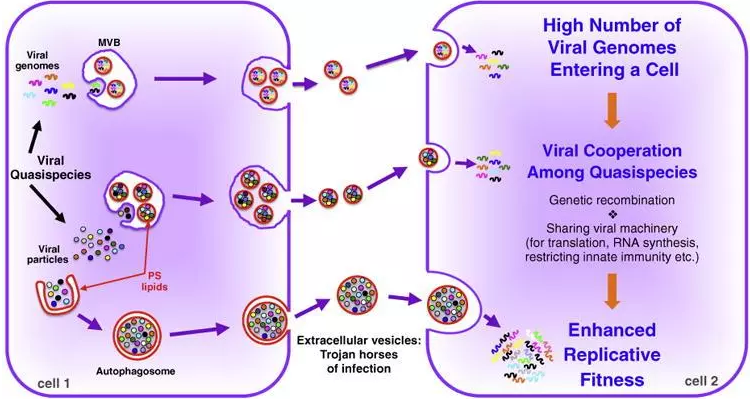
圖5
應用案例2:
Exosome-mediated delivery of functionally active miRNA-155 inhibitor to macrophages. 外泌體介導的功能活性miRNA-155抑制劑對巨噬細胞的作用。PMID:24685946
B細胞來源的外泌體可將外源miRNA-155模擬物或抑制劑遞送到肝細胞或巨噬細胞中,B細胞的刺激可顯著增加外泌體的產生。與親本細胞不同,經過刺激的B細胞中的miRNA-155含量非常低。而裝載miRNA-155模擬物的外泌體可顯著敲除小鼠肝臟中miRNA-155水平。此外,與常規轉染方法相比,外泌體介導的miRNA-155抑制劑遞送可導致更有效的功能抑制和更少的細胞毒性。Momen-Heravi等[12]通過電轉使B細胞來源的外泌體裝載miRNA-155抑制劑, 作用于RAW(264.7)巨噬細胞, 可以降低脂多糖誘導的TNF-α(tumor necrosis factor-α)產生, 同時減輕體內炎癥反應 (圖6)。
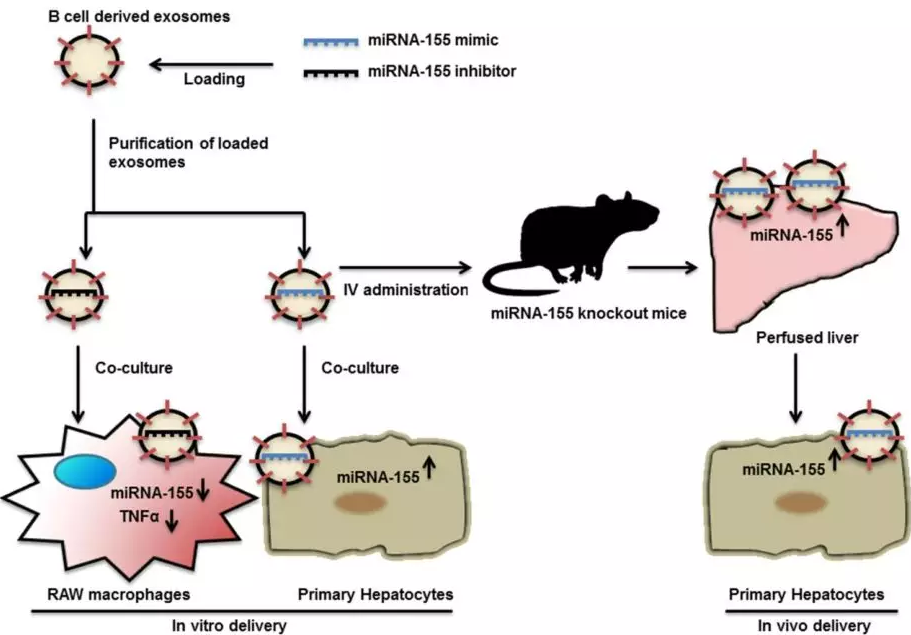
圖6
應用案例3:
Exploitation of Exosomes as Nanocarriers for Gene-, Chemo-,and Immune-Therapy of Cancer.利用外泌體作為癌癥的基因,化療和免疫治療的納米載體PMID:27319211
目前基于載體的癌癥治療面臨的瓶頸,主要是控制治療劑的靶向和釋放。外泌體在尺寸和功能上類似于合成納米顆粒,優點頗多,使其成為靶向藥物或基因遞送載體最有希望的候選物。因此,基于外泌體的癌癥治療有可能成為個性化醫療的重要組成部分。目前的大部分綜述試圖描述外泌體應用于癌癥治療的現狀以及與其使用相關的潛在挑戰。研究發現,外泌體攜帶miRNA轉染癌細胞可導致基因沉默從而抑制細胞增殖、誘導細胞死亡 [13](圖7)。
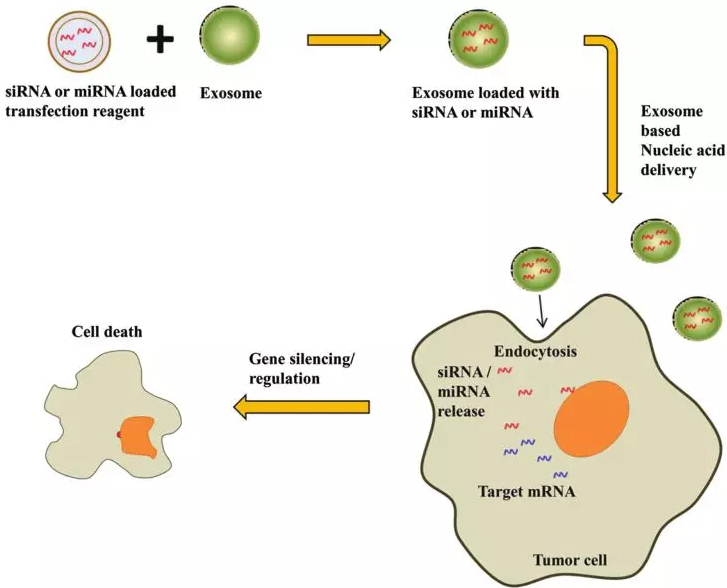
圖7
總而言之,外泌體——在藥物載體領域存在巨大應用潛力,有望成為藥物靶向治療的利器。
4參考文獻
[1]Yeung CLA, Co NN, Tsuruga T, et al. Exosomal transfer of stroma-derived miR21 confers paclitaxel resistancein ovarian canc er cells through targeting APAF1 [J]. Nature communications, 2016, 7: 11150.
[2]Ibrahim A, Marbán E. Exosomes: Fundamental Biology and Roles in Cardiovascular Physiology [J]. Annual Review of Physiology, 2016, 78(1): 67-83.
[3]Srivastava A, Babu A, Filant J, Moxley KM, Ruskin R, Dhanasekaran D, et al . Exploitation of exosomes as nanocarriers for gene-, chemo-, and immunetherapy of cancer. J Biomed Nanotechnol 2016; 12(6): 1159-73.
[4]Pascucci L, Cocce V, Bonomi A, Ami D, Ceccarelli P, Ciusani E, et al. Paclitaxel is incorporated by mesenchymal stromal cells and released in exosomes that inhibit in vitro tumor growth: A new approach for drug delivery. J Control Release 2017; 192: 262-70.
[5]Jang SC, Kim OY, Yoon CM, Choi DS, Roh TY, Park J, et al. Bioinspired exosomemimetic nanovesicles for targeted delivery of chemotherapeutics to malignant tumors. ACS Nano 2016; 7(9): 7698-710.
[6]Tian Y, Li S, Song J, Ji T, Zhu M, Anderson GJ, et al. A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy. Biomaterials 2014; 35(7): 2383-90.
[7]Momen,Heravi F, Bala S, Bukong T, Szabo G. Exosomemediated delivery of functionally active miRNA155 inhibitor to macrophages. Nanomedicine 2014; 10(7): 1517.
[8]Didiot MC, Hall LM, Coles AH, Haraszti RA, Godinho BM, Chase K, et al. Exosome-mediated delivery of hydrophobically modified siRNA for Huntingtin mRNA silencing. Mol Ther 2016; 24(10): 1836-47.
[9]Shtam TA, Kovalev RA, Varfolomeeva EY, Makarov EM, Kil YV, Filatov MV. Exosomes are natural carriers of exogenous siRNA to human cells in vitro. Cell Commun Signal 2013; doi: 10.1186/1478-811X-11-88
[10]Mizrak A, Bolukbasi MF, Ozdener GB, Brenner GJ, Madlener S, Erkan EP, et al. Genetically engineered microvesicles carrying suicide mRNA/protein inhibit schwannoma tumor growth. Mol Ther 2017; 21(1): 101-8.
[11]AltanBonnet N. Extracellular vesicles are the Trojan horses of viral infection. Curr Opin Microbiol. 2016; doi: 10.1016/j.mib.2017.03.005.
[12]Momen,Heravi F, Bala S, Bukong T, Szabo G. Exosomemediated delivery of functionally active miRNA155 inhibitor to macrophages. Nanomedicine 2014; 10(7): 1517.
[13]Srivastava A, Babu A, Filant J, Moxley KM, Ruskin R, Dhanasekaran D, et al . Exploitation of exosomes as nanocarriers for gene-, chemo-, and immunetherapy of cancer. J Biomed Nanotechnol 2016; 12(6): 1159-73.
上一條:酵母雙雜交的那些事
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










