SWATH蛋白質組學技術揭示雙向EET機制案例分析
信息來源:金開瑞 作者:genecreate 發布時間:2018-08-22 22:03:58
題目:Combined spectroelectrochemical and proteomic characterizations of bidirectional Alcaligenes faecalis-electrode electron transfer
Alcaligenes faecalis 雙向EET的光譜電化學和蛋白質組學聯合分析
期刊:Biosensors and Bioelectronics
影響因子:8.173
合作技術:SWATH
研究背景
生物電化學系統可以使用微生物作為生產催化劑。到目前為止,已經證明只有少數微生物可以向細胞內外同時進行電子轉移(即雙向電子轉移),但是微生物和細胞外固體之間的電子交換機制仍然不確定。因此,作者選擇Alcaligenes faecalis,利用蛋白質組學技術,希望揭示雙向EET的機制。
研究內容及結果
1. A. faecalis 雙向EET特征
圖1顯示了A. faecalis在恒定陽極電位+0.3V的三電極系統中下產生的生物電。經過大約一天的滯后,陽極電流急劇增加,在更換陽極介質后,發現發電是可重復的。對于第二和第三循環(分別為14.2 mAm-2和16.9mAm-2)獲得可比較的最大電流密度,表明外向EET途徑的穩定性。同時當A. faecalis在-0.5V的恒定陰極電位下生長時,觀察到電子攝取。前三天急劇增加產生負電流,這說明A. faecalis開始內向EET途徑。從第4天到第18天,陰極電流適度波動,最大值為51.8 mAm-2。如此高的電流表明A. faecalis的內向EET能力強于其外向能力。作者通過掃描電鏡觀察陽極和陰極生物膜的形態發現在陽極和陰極表面均有薄層球狀細胞分布,這為A. Faecalis和電極之間直接EET提供了可能。
伴隨電子吸收,硝酸鹽逐漸消耗,還原產物積累,N2O和銨(NH4+-N)則為中間產物,而在整個實驗中未檢測到亞硝酸鹽。中間產物表明存在兩種不同的硝酸鹽還原途徑,即反硝化和異化硝酸鹽還原成銨(DNRA)。因此,作者認為A. Faecalis利用電極衍生的電子來催化自養反硝化和DNRA。
隨后作者又研究了A. Faecalis生物膜的電化學活性和電子轉移組分。如圖2a和2b所示,陽極和陰極生物膜都顯示出比OCP(開路電位反應器)電極更高的催化電流。對于陽極生物膜,CV掃描結果中出現兩對中點電位(E1/2)(分別為-0.09和-0.32,V vs. SCE)的氧化還原峰,而對于OCP電極沒有觀察到明顯的峰。這兩對電位分別接近枯草芽孢桿菌的細胞色素c-550(E1/2, −0.06 V vs. SCE)、膜細胞色素b554(E0',−0.31 V vs. SCE) 和甲基萘醌(E0',- 0.31V vs. SCE)的氧化還原電位。因此,作者認為膜細胞色素或甲基萘醌可能參與外向EET。陽極和陰極氧化還原峰之間的差異表明,外部和內部有不同的氧化還原成分。作者為了鑒定氧化還原組分是否位于生物膜或培養基中,通過CV以不同的掃描速率掃描電極生物膜。陽極生物膜在-0.30 V的氧化峰電流隨著掃描速率從1到50 mV / s線性增加,并且在-0.70 V的還原峰處觀察到陰極生物膜的相同趨勢。在圖2c和2d的插圖中顯示的峰值電流高度和掃描速率之間的強線性相關性(陽極生物膜的R2 = 0.9872,陰極生物膜的R2 = 0.9959)表明典型的表面控制電化學過程。換句話說,氧化還原組分主要歸因于電極上的生物膜而不是溶液中的溶解物質。
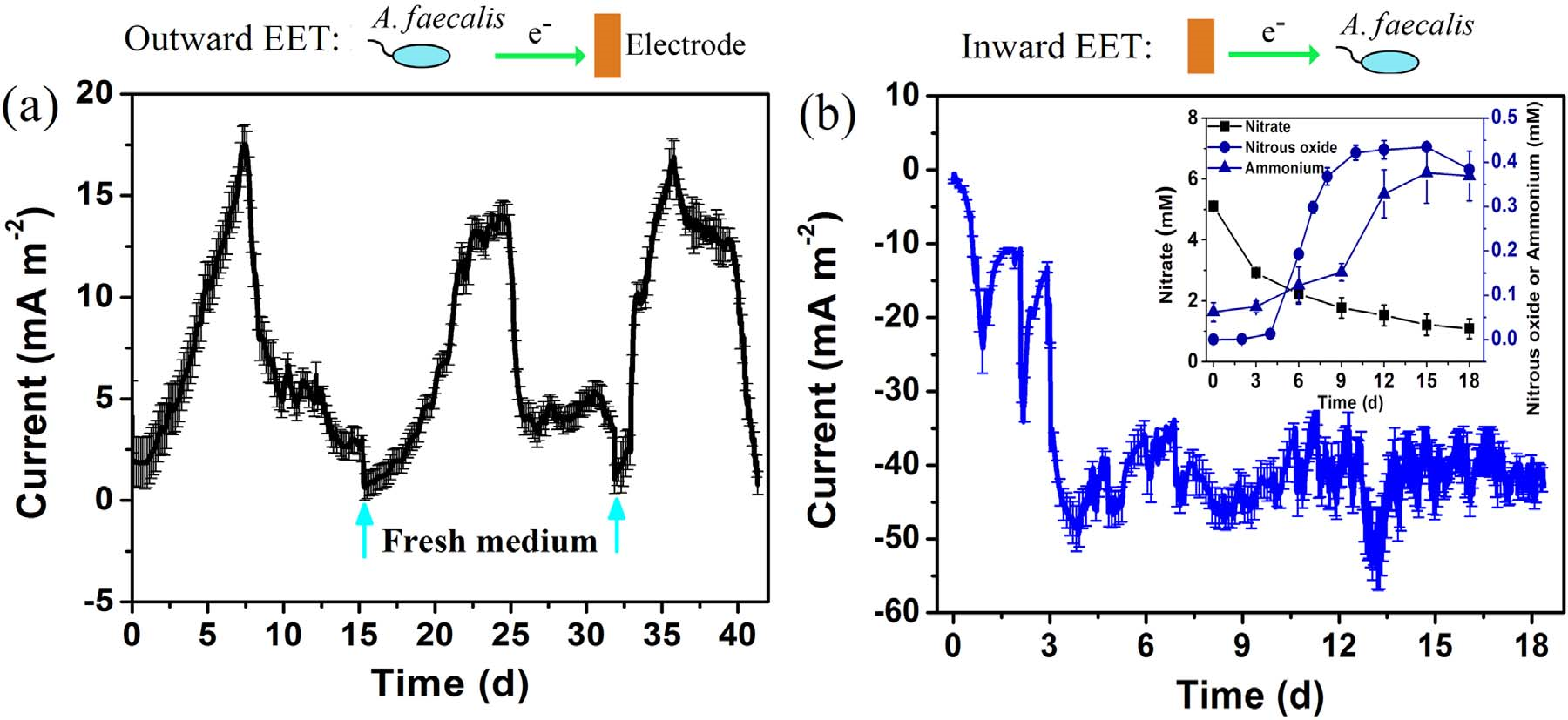
圖1 雙向EET比較
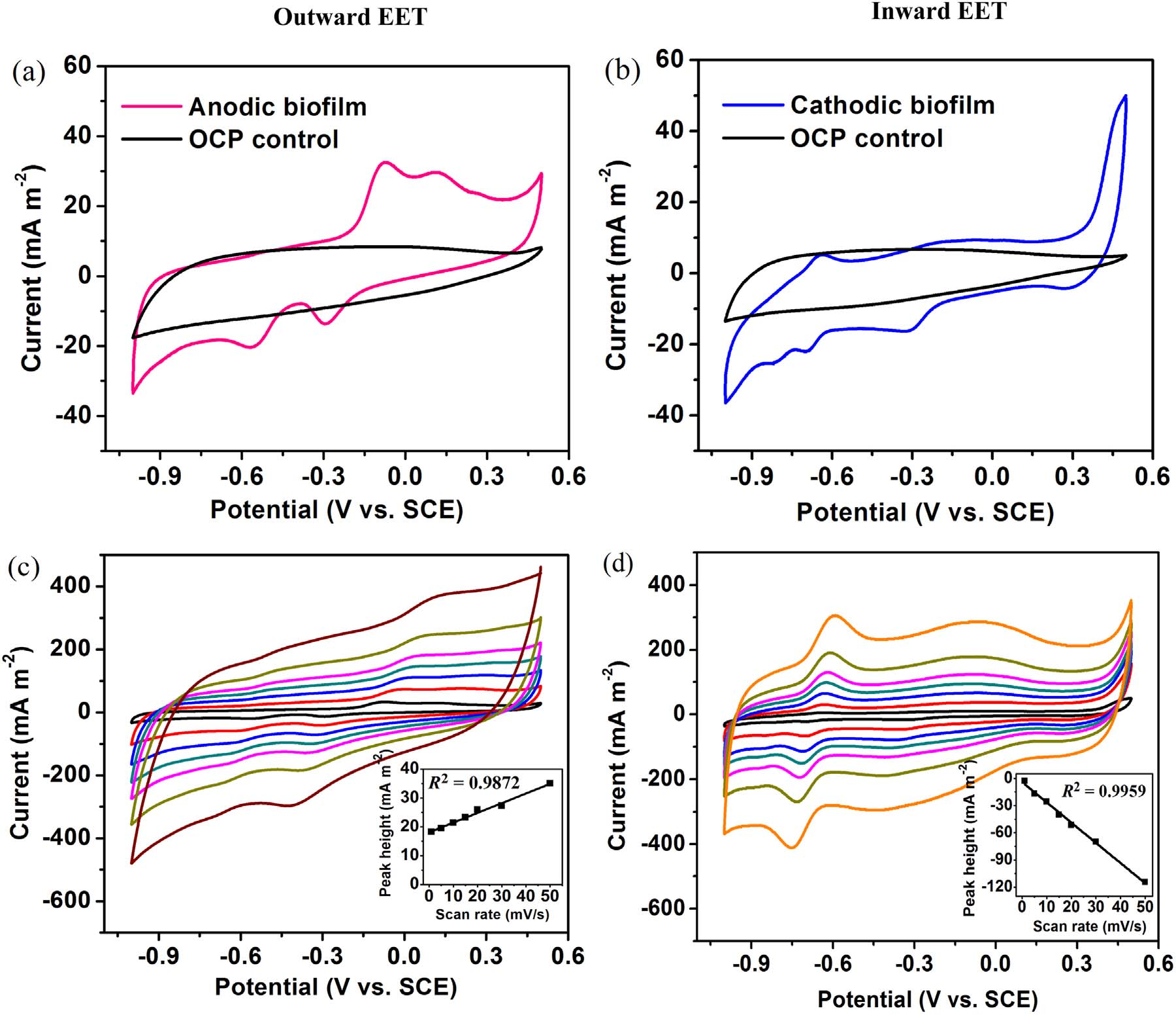
圖2 陽極和陰極生物CV掃描結果
2. 原位EC-FTIRS和電子傳遞抑制劑分析雙向EET途徑
作者又進行了原位EC-FTIRS研究雙向EET的表面氧化還原組分。如圖3a所示,在1248 cm-1和1154cm-1處的條帶為Cyt-c,其強度隨著電極電位的增加而增加,表明Cyt-c可以在高電極電位下被氧化,說明在外向EET期間可以通過Cyt-c向電極轉移電子。與陽極生物膜不同,陰極生物膜在1688 cm-1、1580 cm-1、1479 cm-1、1419 cm-1和1328cm-1出現新信號帶。其中1688 cm-1與Cyt-c中β-turn的amide I相關;1479 cm-1和1580 cm-1與Cyt-c血紅素環裝基團相關。值得注意的是1688 cm-1和1479 cm-1處的條帶在陽極生物膜中無顯著性,這些條帶的高強度表明在陰極生物膜中富集了不同的Cyt-c蛋白。綜上說明參與向外和向內EET是不同的Cyt-c。
為了研究電子如何在質膜中轉移,作者用電子傳遞抑制劑分析對A. Faecalis電化學活性的影響,揭示其雙向EET機制。如圖4a所示,使用0.05mM 抗霉素A(一種阻斷復合物III中CytbH(細胞色素c氧化還原酶)和輔酶Q之間電子轉移的抗生素)后發現對外向EET具有較強的抑制作用。相比之下,0.05mM 抗霉素A加入24h之后幾乎完全抑制了內向EET,這表明內向EET對抗霉素A比對外EET更敏感。加入0.2 mM 阿的平(Quinacrine,阻斷復合物II(琥珀酸脫氫酶)的FAD和FMN中心)后逐漸抑制向外和向內EET,然而內向EET的電流在給予阿的平后約12小時開始恢復,而對外向EET觀察到連續抑制。增加阿的平量至0.4mM,引起外向EET的完全抑制,0.6mM的阿的平僅在1小時內抑制內向EET,然后電流逐漸恢復到其初始值。這表明復合體II對于向外的EET是必不可少的,但對于向內的EET則不是。這種差異反應可能是因為FADH2在存在阿的平的情況下不能通過復合物II向醌池提供電子,因此在外向EET期間沒有再生FAD以維持TCA循環;相反FADH2可以在向內EET期間將電子釋放到還原性TCA循環中。醌環抑制劑雙香豆素(0.2mM)和復合物I(NADH還原酶)抑制劑魚藤酮(0.5mM)對外向EET沒有影響,但顯著抑制內向EET。增加魚藤酮的量至1.0 mM后先增強了內向EET發電量,隨后徹底抑制內向EET。作者認為短時間發電量增強可能是由于刺激細菌呼吸產生的。醌環抑制劑雙香豆素則可以競爭性地抑制電子從復合物I轉移到醌池或反向轉移,向外和向內EET都被雙胍醇在0.6mM強烈抑制。這些結果表明細菌呼吸鏈,即復合物I、II、III和醌池參與向外和向內EET。當添加ATP酶抑制劑DCCD(0.3mM)時觀察到類似的抑制作用,它可以與F0F1 ATP酶的c亞基F0的谷氨酸殘基共價結合從而阻斷質子通道。然而,在DCCD存在的情況下,內向EET立即停止,而向外EET對DCCD的反應相當緩慢。這些結果表明,雙向EET期間的能量增益通過質子動力(PMF)來存儲的,而PMF用于ATP合成。
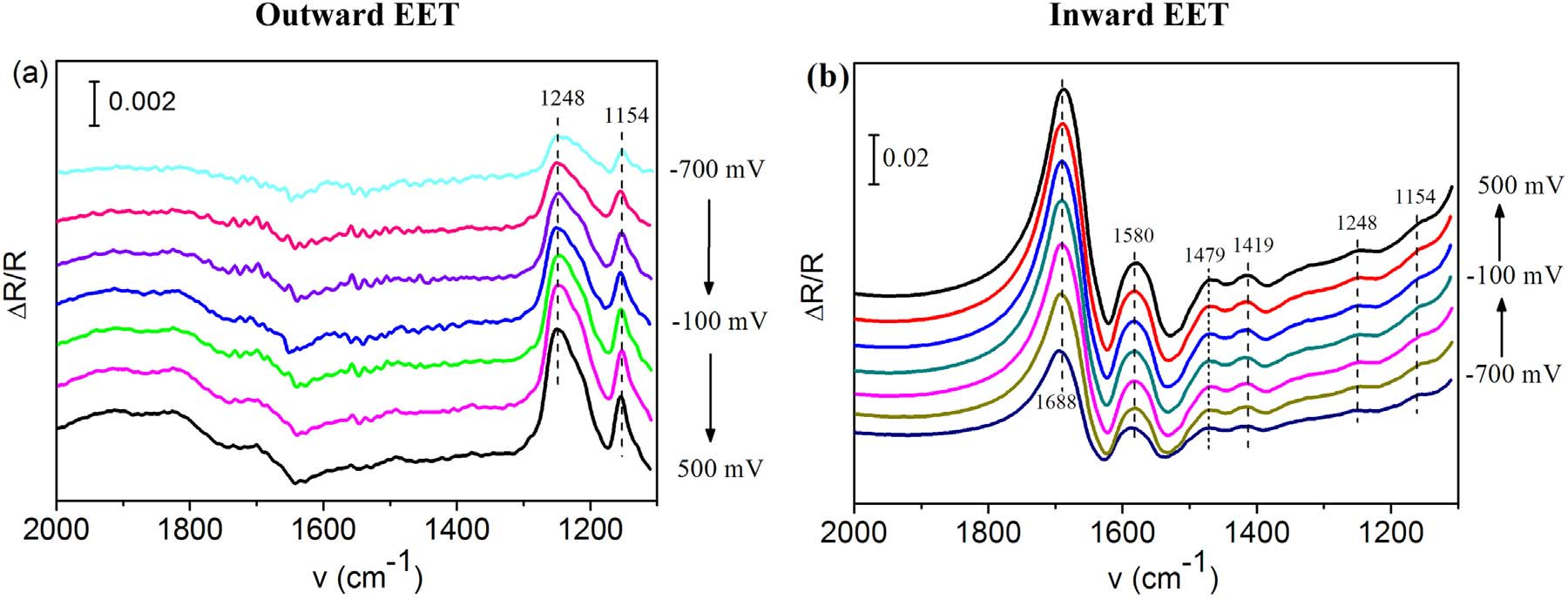
圖3 原位EC-FTIRS結果
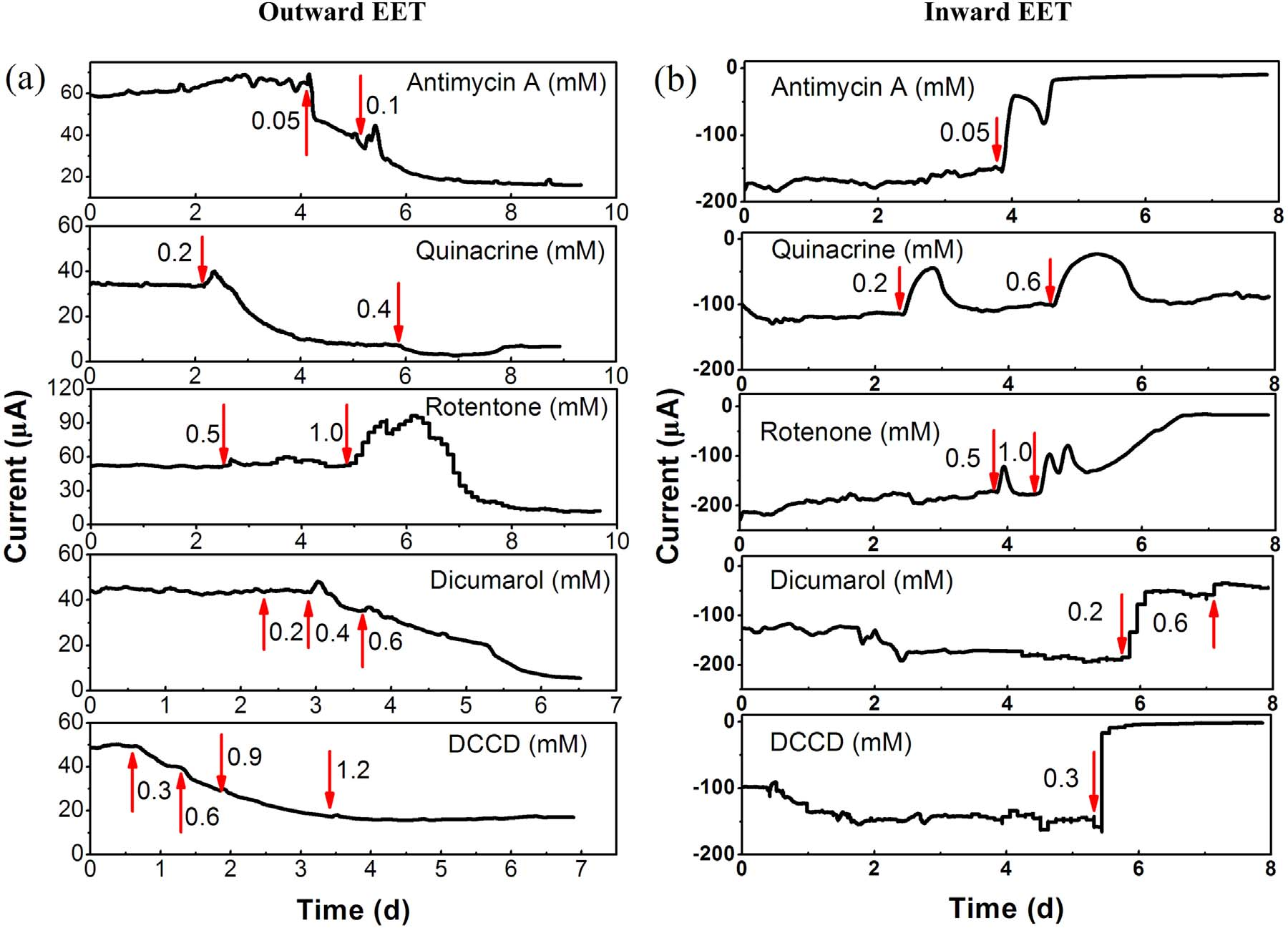
圖4 電子傳遞抑制劑對外向EET(a)和內向EET(b)電流的影響
3. 比較蛋白質組學分析雙向EET組件
由于電子傳遞抑制劑實驗只能揭示質膜上EET通路的一部分,因此作者進行了A. faecalis生物膜的比較蛋白質組學研究,來進一步探討雙向EET機制。作者通過SWATH-MS技術總共鑒定了1727種蛋白質,隨后進行了COG和GO分析,以及不同培養條件(-0.5V、OCP1、+ 0.3V、OCP2)下的蛋白表達水平的層次聚類分析,差異蛋白數目如表1。作者根據差異蛋白COG類別對其進行分類,發現具有最大數量的上調蛋白質的COG分別為陰極生物膜的“能量產生和轉化”和陽極生物膜的“無機離子轉運和代謝”。這說明BES(生物電化學系統)中陰極和陽極生物膜的生長速率受到不同代謝過程的限制。KEGG Pathway富集分析結果顯示在陰極生物膜中有9種通路顯著富集(p <0.05),其中包括CO2固定、TCA循環和丙酮酸代謝等;而在陽極生物膜中顯著富集到15種通路,如脂肪酸代謝、蛋白運輸等。這些結果表明,在雙向EET期間,A. faecalis的不同KEGG途徑是適應性進化的,這不是永久性的,因為這些變化僅限于其代謝而不是基因組。
作者把關注的重點放在與電子轉移相關的蛋白上,與OCP對照相比,細胞色素c、復合物I的泛醌氧化還原酶L亞基在陰極和陽極生物膜中均高度表達。這些結果與觀察到的復合物I和細胞色素c在定向EET中的參與一致。在陰極生物膜中,甲酸脫氫酶和亞硝酸氧化還原酶上調,但在陽極生物膜中下調,表明這兩種蛋白質可能分別在內向EET CO2固定和反硝化過程中起重要作用。NADH-醌氧化還原酶亞基N、外膜蛋白(A0A0A2N7I9)、外膜外排蛋白(J0UXU4)、周質結合蛋白(J0JEG5)在陰極生物膜中表達上調。電子轉運蛋白RnfB、氧化還原酶(A0A0A2NEJ3)和細胞色素c過氧化物酶在陽極生物膜中表達上調,陰極生物膜中下調,表明這三種蛋白質對外向EET至關重要,但對內向EET則無效。RnfB作為復合物Rnf的亞基,是與膜相關的多聚蛋白,它接受來自鐵氧還蛋白的電子并將它們轉移到其他Rnf亞基,Rnf復合物利用釋放的能量將Na+泵出細胞,電化學Na+電位的跨膜差異可能驅動Na+依賴性ATP合成。有研究認為鞭毛蛋白的作用與促進生物膜的形成以及電極表面和細胞之間的通信以及電生成有關,作者也在本研究中發現陽極生物膜的鞭毛蛋白(J0ULP1)的高表達,同樣菌毛組裝蛋白CpaB的表達量也發上調,說明A. faecalis菌毛可能參與外向EET。CpaB僅在陰極生物膜中略微上調,表明內向EET的電子攝取可能通過與外向EET不同的途徑發生,外膜蛋白(J0JDR6)在陽極和陰極生物膜中均上調意味著J0JDR6可能參與雙向EET。
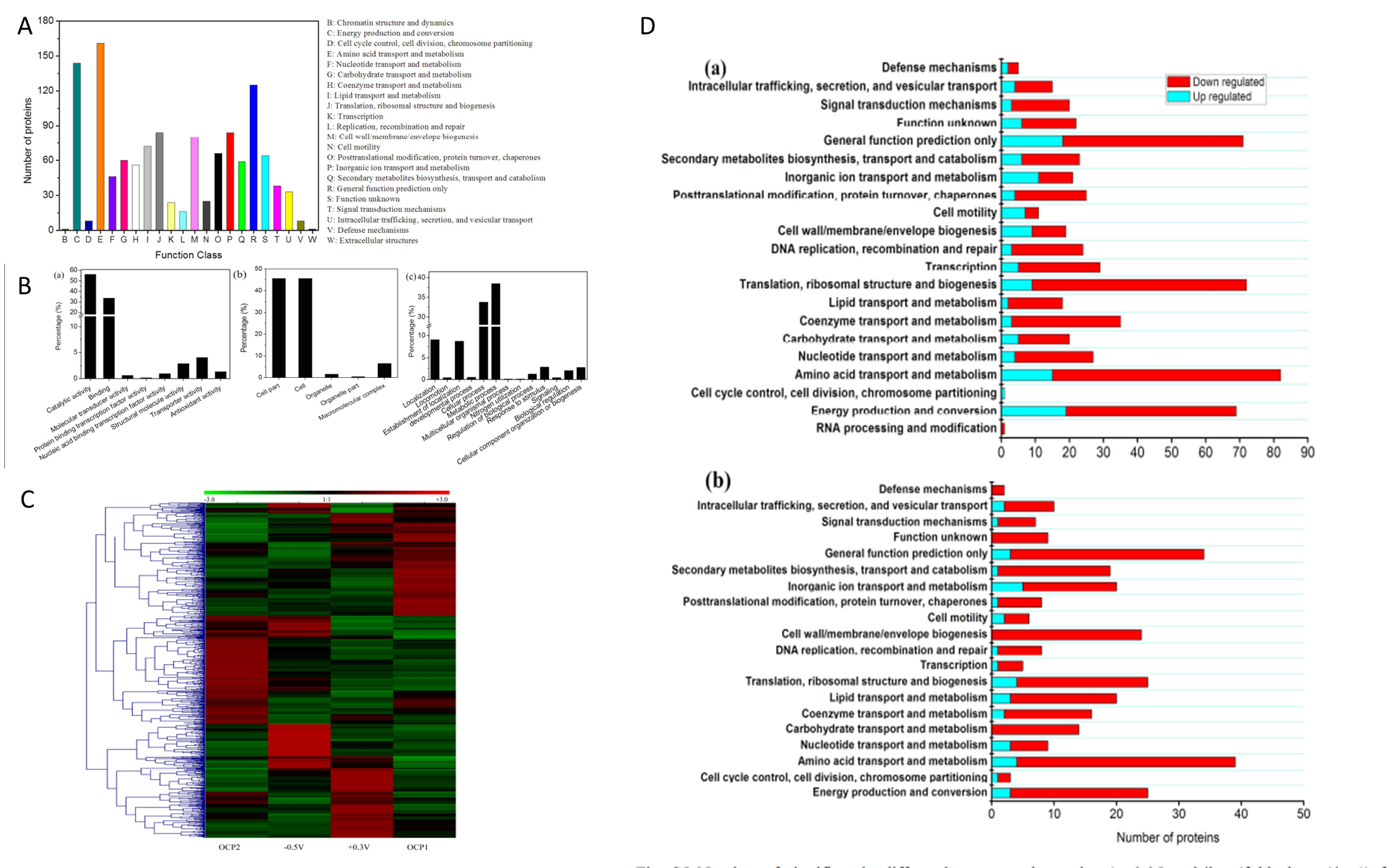
圖5 A. faecalis 蛋白質組學分析
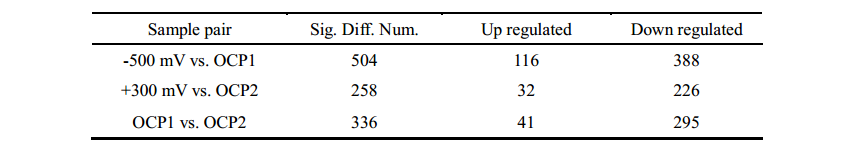
表1 差異蛋白統計(Fold > 2,p < 0.05)
4. 雙向EET模型
作者根據蛋白質組學和電子傳遞抑制劑實驗結果,提出了雙向EET模型。對于外向EET,從乙酸鹽氧化釋放的電子通過TCA循環細菌呼吸鏈細胞色素-c過氧化物酶或菌毛陽極連續轉移產生NADH + H+或FADH2,產生質子動力(PMF),驅動ATP合成。另外一種可能則是細菌呼吸鏈的細胞色素-c可能首先將電子轉移到外膜蛋白,例如J0JDR6,后者通過菌毛直接或間接地向陽極提供電子。對于內向EET,細胞陰極界面處的電子吸收可能通過外膜蛋白進行,電子被周質細胞色素-c接受,隨著PMF的產生,細胞色素-c向下游提供電子到反硝化的NOx還原酶,同時電子很可能通過PMF的消耗向上傳遞到細菌呼吸鏈,產生還原能力(NADH和FADH2),還原能力最終用于TCA循環中以還原CO2。
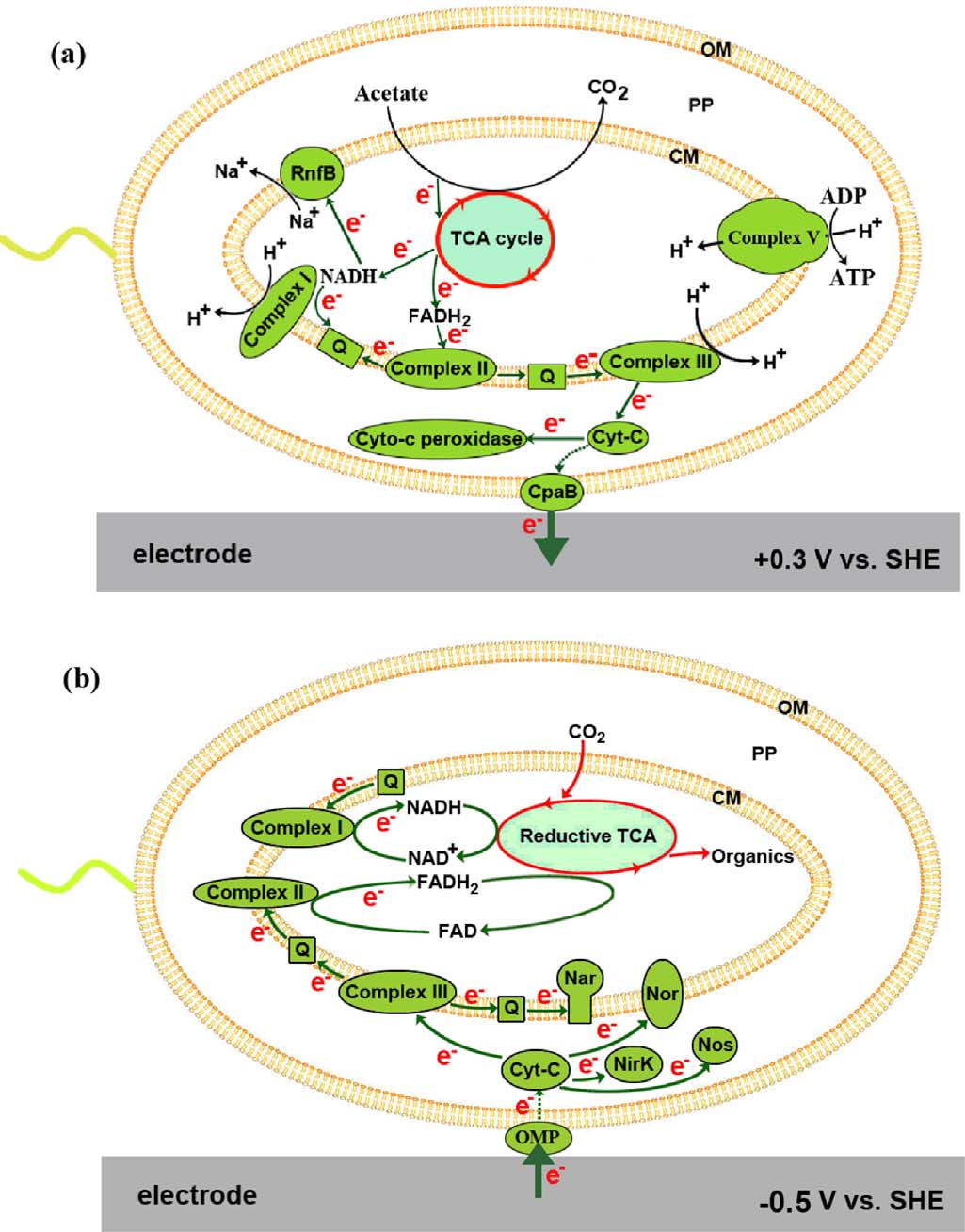
圖6 A. faecalis雙向EET模型
文章小結
A. faecalis可催化外向EET發電和內向EET進行自養反硝化。在質膜中,向外和向內的EET途徑彼此相似,因為復合物I,II,III和醌池在兩個方向上都參與。但是在周質和外膜中,在向外和向內EET期間使用不同的氧化還原組分。此外,菌毛蛋白和外膜蛋白分別負責EET向外和向內的界面。總體而言,作者提供了一種用于闡明微生物EET途徑的組合方法。
解析文獻
Linpeng Yu, Yong Yuan,et al. Combined spectroelectrochemical and proteomic characterizations of bidirectional Alcaligenes faecalis-electrode electron transfer. Biosensors & Bioelectronics, 2018 , 106 :21-28.
參考文獻
1. Pereira-Medrano, A.G., Knighton, M., et al. Quantitative proteomic analysis of the exoelectrogenic bacterium Arcobacter butzleri ED-1 reveals increased abundance of a flagellin protein under anaerobic growth on an insoluble electrode . 2013. J. Proteom. 78, 197–210.
2. Barco, R.A., Emerson, D., et al. New Insight into Microbial Iron Oxidation as Revealed by the Proteomic Profile of an Obligate Iron-Oxidizing Chemolithoautotroph. 2015. Appl. Environ. Microbiol. 81 (17), 5927–5937.
3. Kumar, A., Hsu, L.H.H., et al. The ins and outs of microorganism–electrode electron transfer reactions . 2017, Nat. Rev. Chem. 1, 0024.
4. Yang, Y.G., Kong, G.N., et al. Electricity Generation by Shewanella decolorationis S12 without Cytochrome c. 2017. Front.Microbiol. 8, 1115.
下一條:轉錄組、蛋白質組學聯合案例分析
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










