轉錄組、蛋白質組學聯合案例分析
信息來源:金開瑞 作者:genecreate 發布時間:2018-08-29 16:06:38
標題:Transcriptomic, Proteomic, and Bioelectrochemical Characterization of an Exoelectrogen Geobacter soli Grown With Different Electron Acceptors
用不同電子受體培養的產電菌群Geobacter soli Grown的轉錄組學、蛋白質組學和生物電化學表征
期刊:Front Microbiol
影響因子:4.019
研究背景
Geobacter是一種發電菌屬,其細胞外電子轉移(EET)能力在生物地球化學和生物能源過程中發揮重要作用,作者選擇Geobacter soli GSS01菌種,利用轉錄組學、蛋白質組學技術希望揭示EET在不同Geobacter菌種之間的差異。
研究結果
1. G.soli的細胞外電子轉移(EET)能力
作者培養了G.soli和G.sulfurreducens PCA兩種菌株,發現這兩種菌株都能夠還原四種常見的不溶性Fe(III)氧化物。隨著培養時間的延長,GSS01菌株還原生成的Fe(II)產物量比PCA菌株多,這些結果表明GSS01菌株可能比PCA菌株更快地還原Fe(III)氧化物。在電流密度和電流強度方面,GSS01菌株也高于PCA菌株。
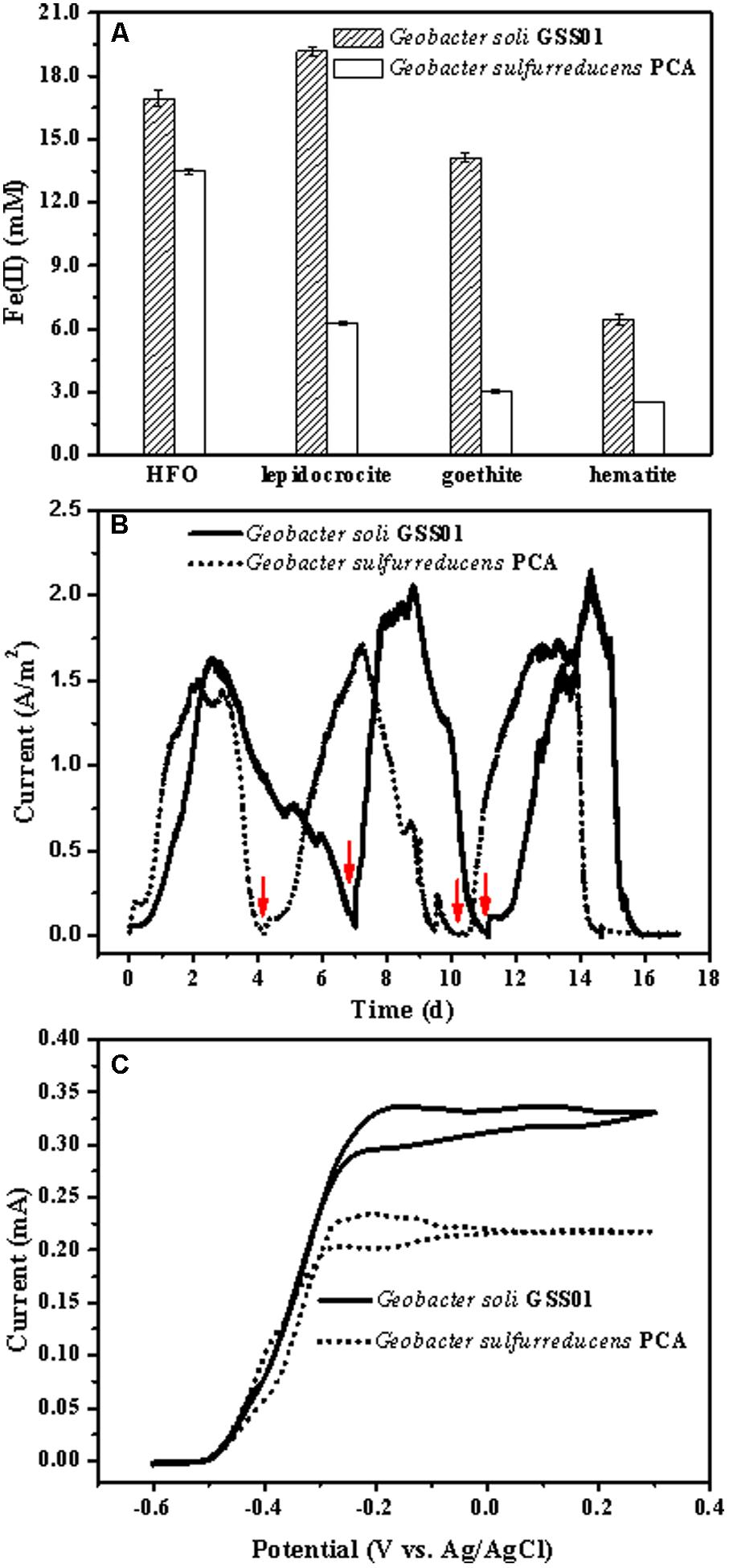
圖1 G.soli GSS01和G.sulfurreducens PCA 的EET能力比較
2. G.soli生物膜的生物電化學特征
為了準確識別出負責發電的生物催化活性位點,作者使用non-turnover CV法和turnover DPV法分析菌株生物膜,發現兩種生物膜均顯示出兩個主要的氧化還原狀態(E2、E3)和一種次要氧化還原狀態(E1)。而且G.soli生物膜中也存在一個獨特的次要氧化還原狀態,其形式電位為-0.20 V(E4)。除此之外,EIS分析顯示,G.solid 生物膜具有比G.sulfurreducens更低的電荷轉移電阻(Rct)。
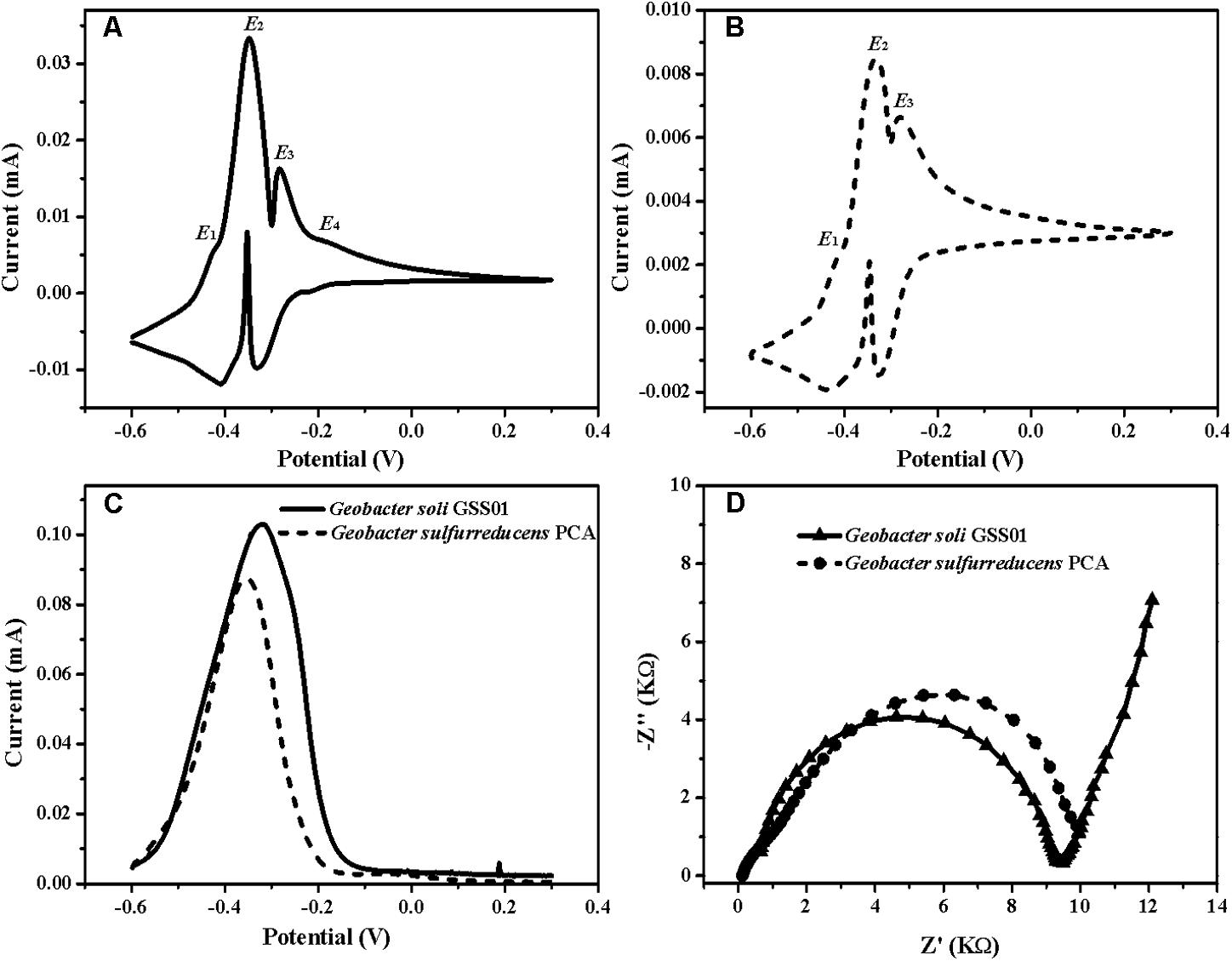
圖2 G.soli GSS01和G.sulfurreducens PCA 生物膜電化學結果
3. 外氧化還原蛋白的電化學原位 FTIR光譜
作者采用電化學原位 FTIR光譜獲得更多關于G.soli細胞表面蛋白的信息,并在分子水平上監測它們在電化學反應過程中的構象變化。結果顯示,對于用FC和ITO生長的G.soli細胞,在1552、1458、1400、1248和1150cm-1處出現正帶。與用在1650cm-1處具有明顯條帶的FC生長的細胞的光譜相比,用ITO生長的G.soli細胞的光譜在1700-1600cm-1處具有一個更寬的條帶。此外,圖3 C的帶肩從1640移動到1670cm-1,電位從-0.7增加到0.3V,并且在-0.1V 處將該帶分成1668和1620cm-1處的兩個帶。不同光譜振動反映了由電子受體引起的G.soli細胞的外部蛋白質的獨特模式。酰胺I帶和其他帶的顯著差異表明,在G.soli和G.sulfurreducens之間有獨特的外部氧化還原蛋白促進兩種Geobacter菌種的電化學行為。由于具有較高氧化還原電位的外表面蛋白將促進電子從周質向外傳遞,作者推測額外的氧化還原蛋白一方面可能有助于提高G.soli的EET能力,另一方面表明在G.soli中可能存在未知的電子傳遞導管。
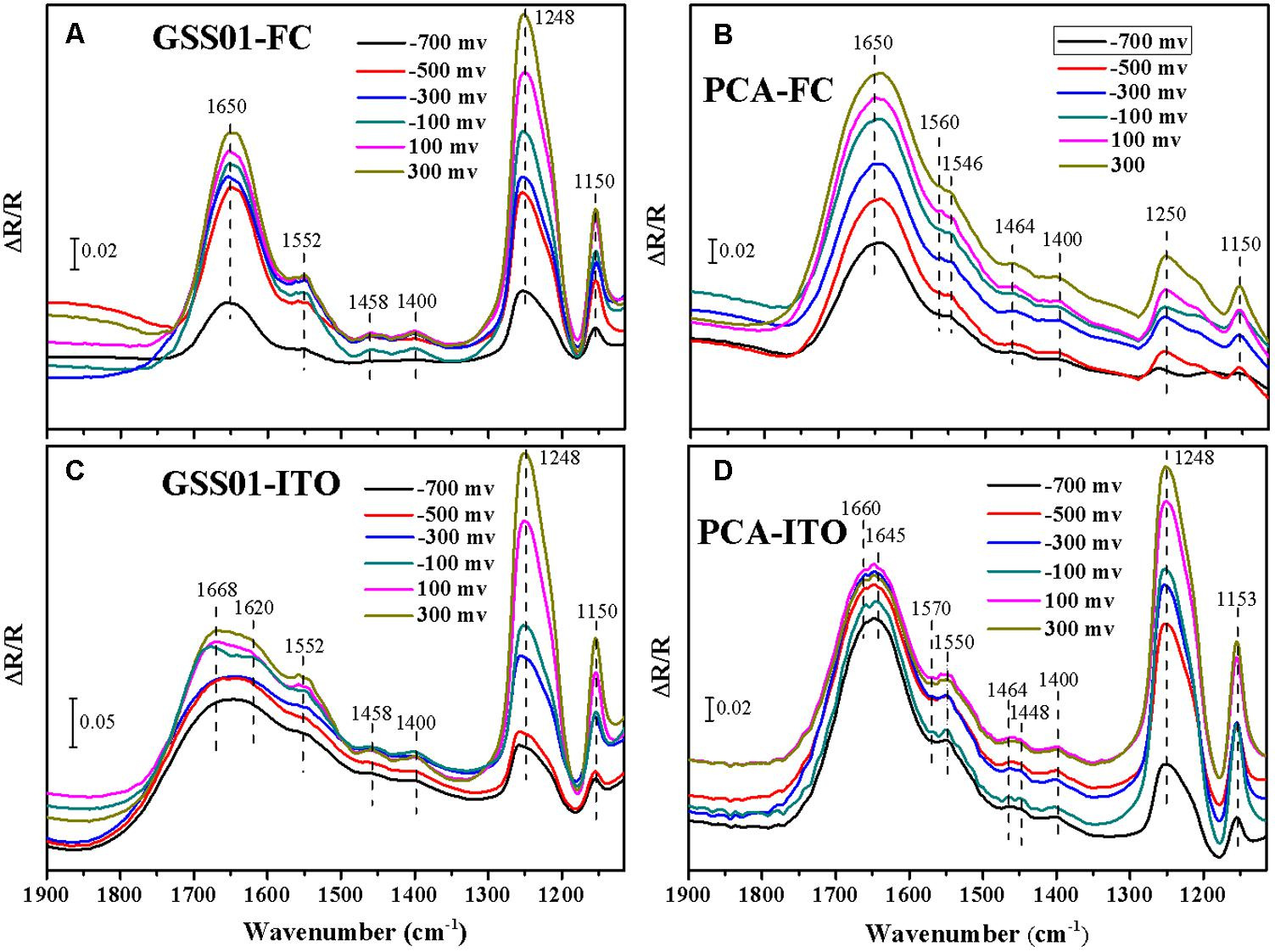
圖3 電化學原位 FTIR光譜分析結果
4. 轉錄組學和蛋白質組學分析
在轉錄組學結果中,作者分別鑒定到了2013(FH vs FC)、1705(ITO vs FC)差異基因(Pvalue≤0.05),在蛋白質組學結果中,共鑒定到了2149個蛋白質,差異蛋白數分別為409(FH vs FC)、207(ITO vs FC)(FC≥1.5,Pvalue≤0.05)。作者發現,許多在轉錄組學分析中具有較高轉錄水平的基因,例如cbcL、imcH、rplE和rplN,在蛋白質組學分析中具有降低的翻譯水平,這可能是因為膜相關蛋白的低提取產率或表達的轉錄后調節。
5. 與代謝和生長相關的蛋白質
在本次研究中,作者選擇了與三羧酸(TCA)循環、氧化磷酸化和翻譯相關的基因、蛋白質的表達水平進行了分析。
在TCA循環中,使用FH和ITO的細胞生長期間,與代謝率直接相關的檸檬酸合酶(GltA)的表達水平在轉錄組學和蛋白質組學分析中均下調。在轉錄組學分析中,三種琥珀酸脫氫酶編碼基因(frdA,frdB和frdC)、蘋果酸脫氫酶(mdh)和異檸檬酸脫氫酶(icd)編碼基因的表達水平下調。TCA循環中許多基因的轉錄水平,如frdB和烏頭酸氫鹽編碼基因acnA,在用ITO生長的細胞中的蛋白豐度比在用FH生長的細胞蛋白豐度更低,說明用ITO生長的細胞中的代謝率較低。
在使用FH或ITO細胞生長期間,催化呼吸代謝反應酶的調節是復雜的。在蛋白質組學分析中,F0F1型ATP合酶的一個亞基(AtpH)在用FH生長的細胞中比在FC中表達量上調,而另一個亞基(AtpG)則表達量下調;在轉錄組學分析中,細胞色素c氧化酶(CoxA、CoxC和CoxD)的表達上調,細胞色素bd甲基萘醌氧化酶(CydA)的表達下調。這和已有的G.sulfurreducens研究結果一致,即兩種NADH脫氫酶復合物在所有測試條件下均表達,但不同亞基的豐度是不同的。一般來說,大多數亞基在FH生長過程中比FC更豐富,但在ITO生長過程中豐度低于FC,這也表明使用ITO生長的細胞代謝率低于FH。
更多的核糖體產生表明微生物有更快的生長速率。蛋白質組學分析中,許多核糖體蛋白在FH和ITO培養的細胞中的豐度比FC低約1.5-25倍,這支持了不溶性電子受體細胞生長較慢的結論。然而,大多數這些核糖體蛋白編碼基因的轉錄水平在用FH和ITO生長的細胞中比在FC中更豐富。該結果表明核糖體蛋白的表達高度依賴于如前所述的轉錄后控制。
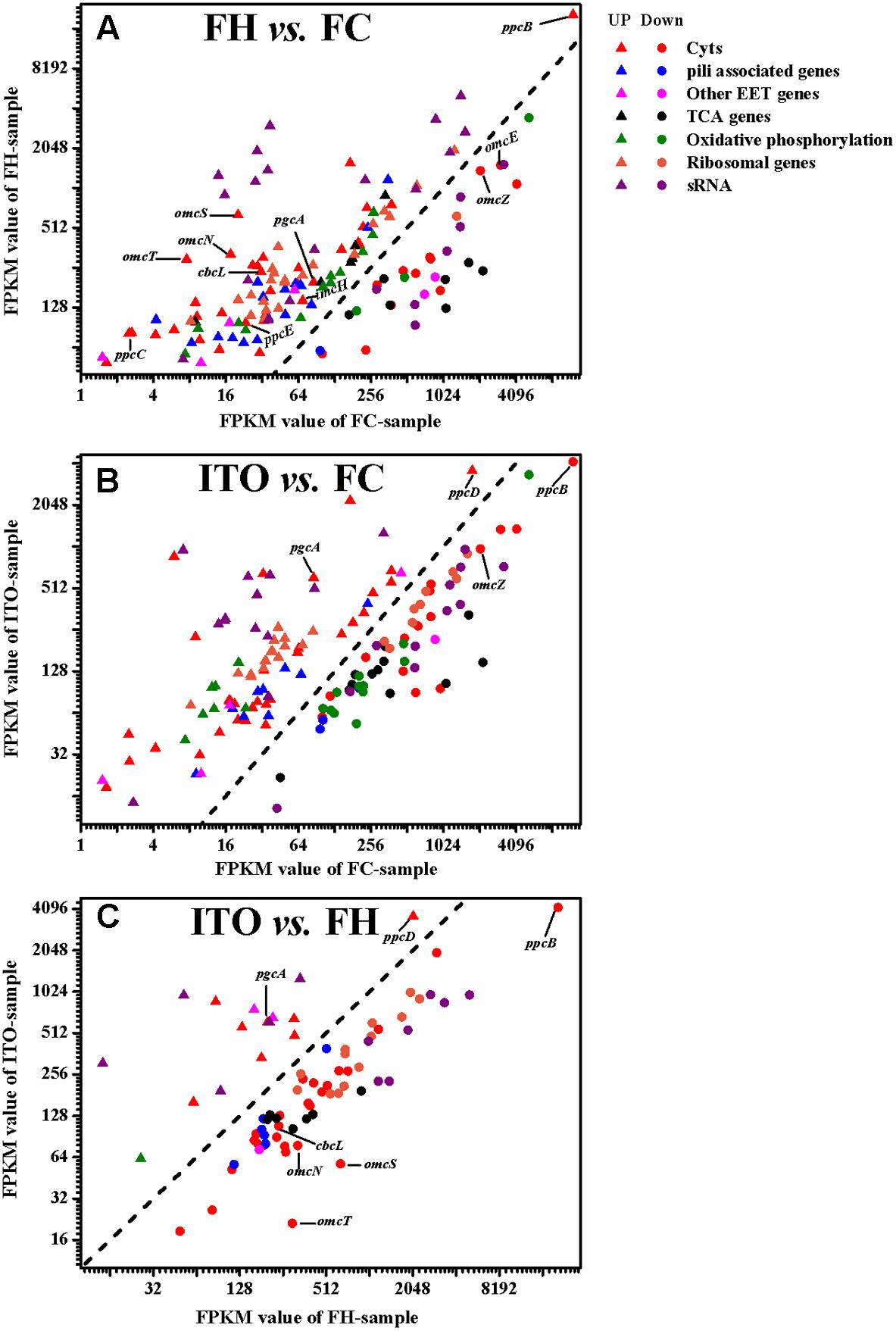
圖4 G.soli細胞轉錄表達水平比較
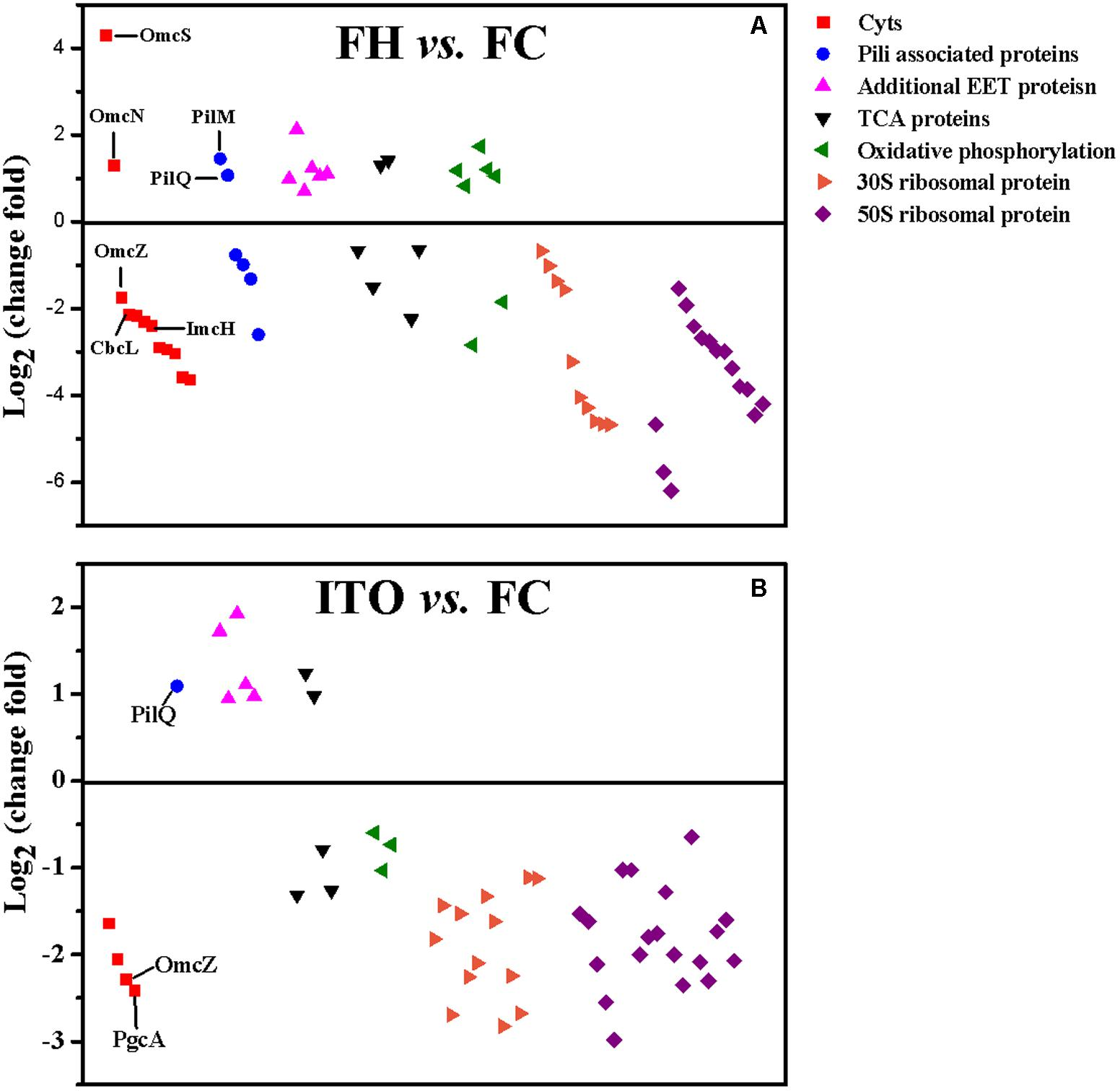
圖5 G.soli細胞蛋白表達水平比較
6. 可能參與EET的蛋白質
作者認為可能參與EET的蛋白主要包括細胞色素蛋白、菌毛相關蛋白、額外的電子轉移蛋白、小的非編碼RNA(sRNA)等。
目前來自G.sulfurreducens研究表明,許多c-Cyt蛋白在EET中起重要作用:(1)內膜電子轉移至少通過兩種不同的途徑,分別為CbcL-依賴途徑和ImcH-依賴途徑;(2)從內膜到外膜的電子轉移可能是由PpcA家族(PpcA-PpcE)介導;(3)通過外膜轉移電子依賴于反式外膜孔;(4)從外膜到電子受體的末端電子轉移由OmcS和OmcZ介導。
在轉錄組分析結果中,共有62個c-Cyts顯著差異編碼基因,其中有23個在兩組中表達皆上調。基因cbcL和imcH的表達在用FH生長的細胞中分別上調7.6和2.1倍,而在用ITO生長的細胞中沒有明顯變化。在蛋白質組學分析中,蛋白質cbcL在用FH生長的細胞中表達下調。由于FC,FH和ITO的氧化還原電位彼此不同,含有FC和FH的培養物的氧化還原電位將隨著Fe(III)還原而降低,說明這兩種蛋白質的調節不僅直接依賴于電子受體的類型,而且還依賴于培養物中Fe(III)-還原比率。
在五個密切相關的小型三聚體c -Cyts PpcA家族中,ppcB、ppcC和ppcE的轉錄水平在用FH生長的細胞中上調,而ppcD在用ITO生長的細胞中比在FC中具有更高的轉錄水平。作者推測這些蛋白質均通過PSORT進行周質定位。
omcB基因在FH和 ITO生長的細胞中的轉錄水平均上調,但它的翻譯水平在蛋白質組分析結果顯示并沒有明顯變化。在蛋白質組學分析中,用FH或ITO生長的細胞中兩個表達上調的蛋白的c-Cyts是SE37_02820和SE37_11760,而在G.sulfurreducens中最接近SE37_02820的同源物是OmcS,具有94.7%的氨基酸序列同一性。之前G.sulfurreducens中的研究證實,OmcS是末端Fe(III)氧化物還原酶,但對于電極還原不是必需的。OmcZ在促進從生物膜到電極表面的電子轉移方面發揮重要作用,已發表的研究結果認為omcZ的轉錄水平在不可溶電子受體中表達大幅度上調。然而,在本研究中作者發現,與FC生長的細胞相比,在FH和ITO生長的細胞中omcZ(SE37_04285)轉錄和翻譯水平顯著降低。
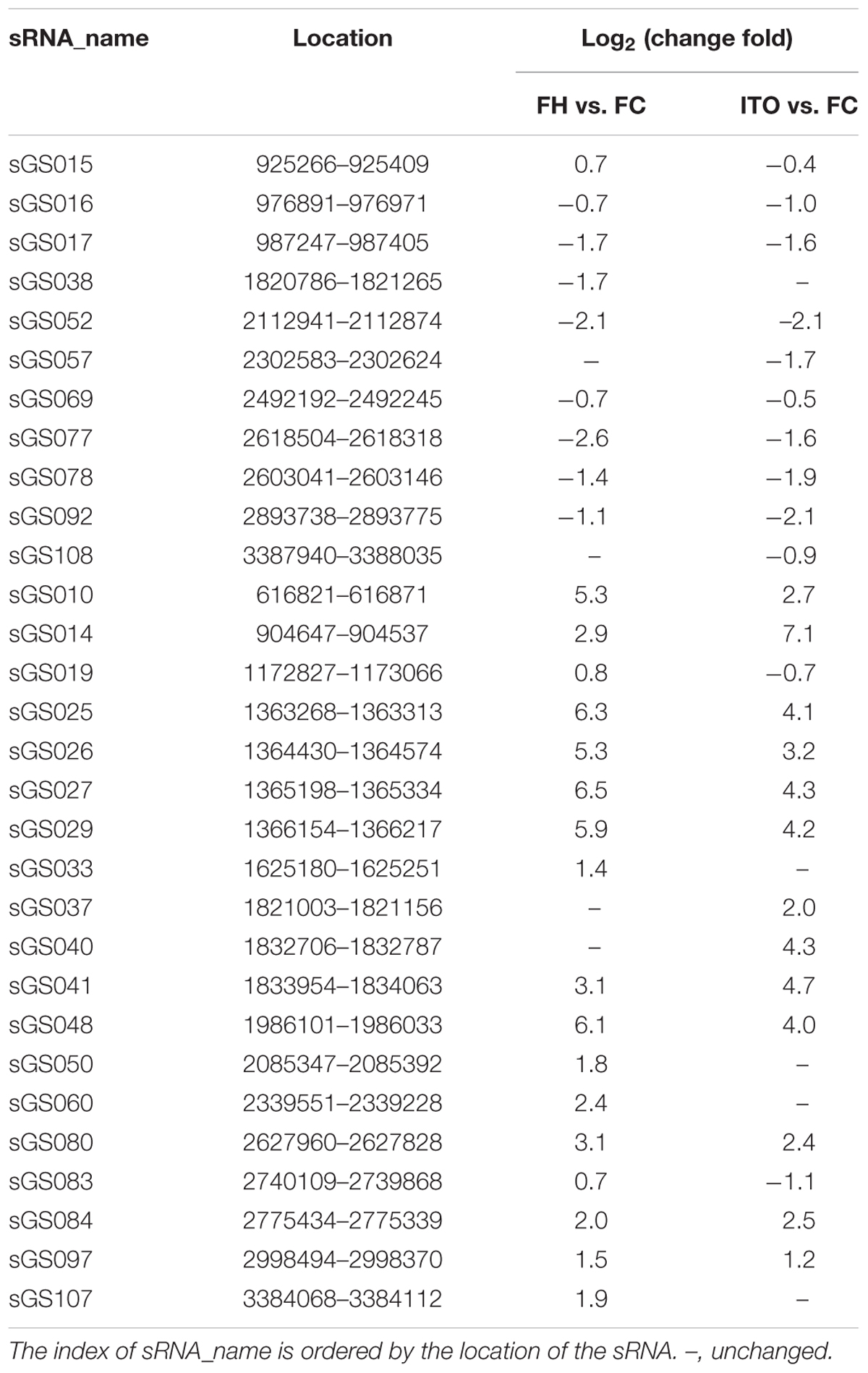
細菌中的許多外膜蛋白都是通過sRNA調節的,而外膜蛋白對EET很重要,因此sRNA的差異表達同樣很重要。比較轉錄組學顯示,在用不溶性電子受體和可溶性受體生長的G.soli細胞中差異表達30種新型sRNA,差異表達最大的sRNA是sGS014。為了進一步研究sRNA在EET中的潛在作用,作者使用RNA相互作用預測工具IntaRNA分析差異表達的sRNA和EET基因之間的相互作用,結果顯示sGS014可以與30個EET基因相互作用,并且預測兩個外膜c -Cyts SE37_11760和SE37_11830與多達28個不同的sRNA相互作用。由于幾乎所有鑒定的sRNA都在較低選擇壓力的基因間區域編碼,因此它們在不同的Geobacter物種中具有更大的突變空間。sRNA可參與調節不同Geobacter物種中EET基因的表達,需要進一步研究以確定它們對基因表達的物種特異性調節的影響。
表1部分重要的c- Cyt蛋白和可能參與EET的其他蛋白質
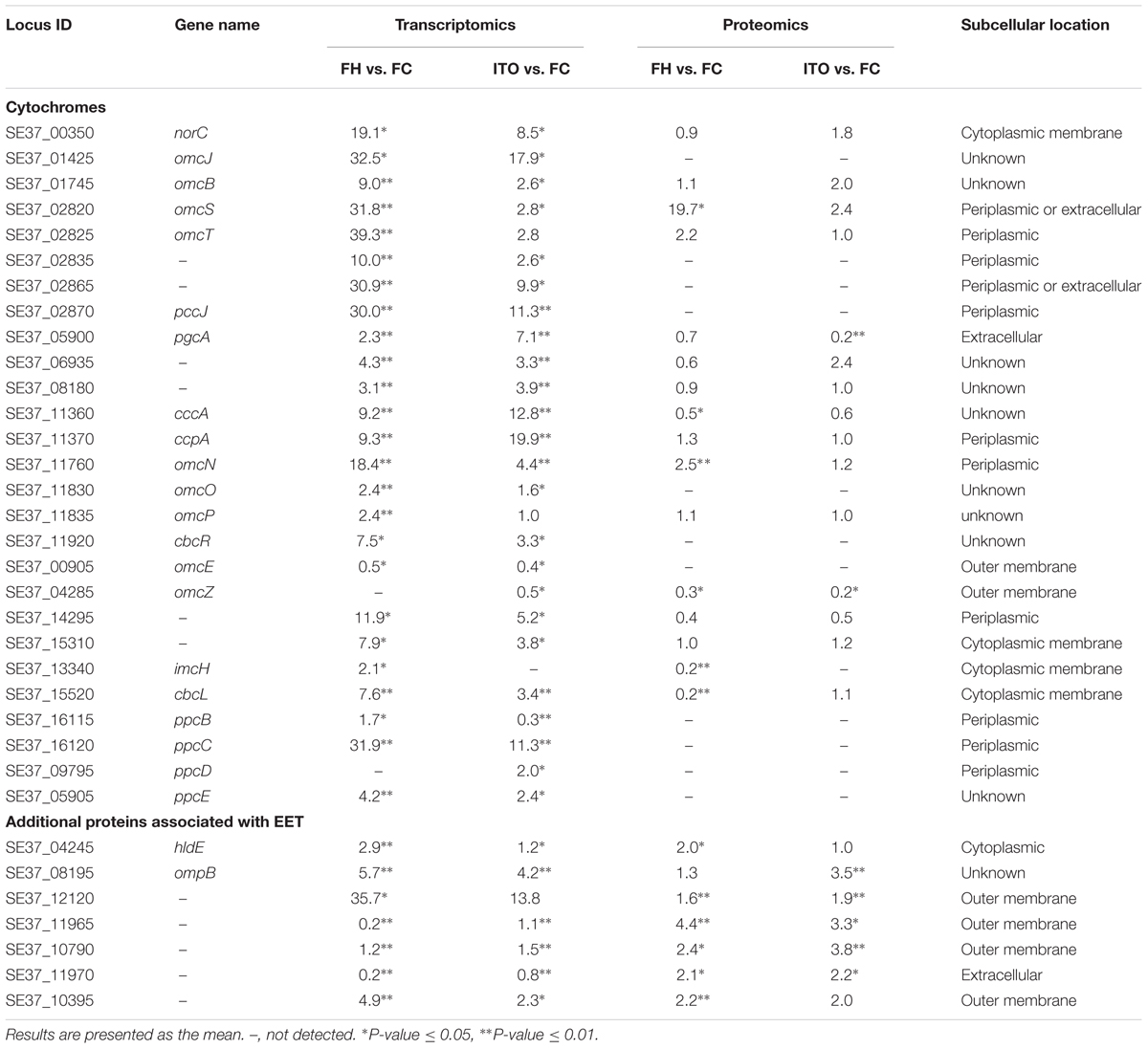
表2 差異表達的sRNA候選物
研究結論
本研究表明,G.soli是一種有潛力的Fe(III)氧化物還原劑和電流產生劑,其EET機理值得進一步研究。在用不溶性電子受體和可溶性電子受體生長的G.soli細胞中鑒定到具有顯著差異豐度的蛋白質集,可用于將來對該物種中EET機制的研究。sRNAs在Geobacter屬中調節EET基因表達的可能性為探索EET機制提供了新的理論基礎。
解析文獻
Xixi Cai, Lingyan Huang, et al. Transcriptomic, Proteomic, and Bioelectrochemical Characterization of an Exoelectrogen Geobacter soli Grown With Different Electron Acceptors. Frontiers in Microbiology , 2018 , 9 :1075.
參考文獻
1. Ding, Y. R., Hixson, K. K.,et al. (2008). Proteome of Geobacter sulfurreducens grown with Fe(III) oxide or Fe(III) citrate as the electron acceptor. Biochim. Biophys. Acta 1784, 1935–1941.doi: 10.1016/j.bbapap.2008.06.011
2. Yang, G., Chen, S., Zhou, S., and Liu, Y. (2015). Genome sequence of a dissimilatoryFe(III)-reducing bacterium Geobacter soli type strain GSS01T. Stand. GenomicSci. 10:118. doi: 10.1186/s40793-015-0117-7
3. Merkley, E. D., Wrighton, K. C., et al. (2015). Changes in protein expression across laboratory and field experiments in Geobacter bemidjiensis. J. Proteome Res. 14, 1361–1375.doi: 10.1021/pr500983v
4. Kavanagh, P., Botting, C. H., et al. (2016).Comparative proteomics implicates a role for multiple secretion systems in electrode-respiring Geobacter sulfurreducens biofilms. J. Proteome Res. 15, 4135–4145. doi: 10.1021/acs.jproteome.5b01019
下一條:慢病毒包裝經典文獻解析
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










