外泌體蛋白質組經典文章—UBL3影響蛋白質向小型胞外囊泡轉化
信息來源:金開瑞 作者:genecreate 發布時間:2018-12-05 15:42:48
題目:UBL3 modification influences protein sorting to small extracellular vesicles
期刊:Nature Communications
影響因子:12.353
研究背景
外泌體是一種小型胞外囊泡(sEVs),來自于多泡體(MVBs),通過運輸蛋白質、mRNA和miRNA介導細胞間的通信。然而,哪類蛋白質被歸為sEVs的分子機制還不是完全清楚。在這里,作者報道了泛素樣3(UBL3)膜錨定的Ub折疊蛋白MUB作為翻譯后修飾因子PTM調節蛋白向胞外囊泡轉化。作者發現UBL3的修飾對于將UBL3歸類到MVBs是不可缺少的。同時作者還發現從UBL3缺失型小鼠樣本中純化的sEVs總蛋白,與野生型小鼠相比減少60%,并從蛋白質組學分析結果中發現了1241個與UBL3互作蛋白,包括Ras。作者展示了UBL3改變Ras基因和致癌基因RasG12V突變體,UBL3的表達促進RasG12V到sEVs的轉變。綜上所述,結果表明PTM被UBL3取代并影響蛋白到sEVs的歸類轉化。
研究內容及結果
1. UBL3作為轉錄后調控因子的分析
目前對于UBL3作為PTM轉錄后調節因子的作用還不清楚,為了明確這一調控機制,作者在MDA-MB-231乳腺癌細胞中過表達帶Flag的Flag-UBL3(16kDa),并通過免疫共沉淀純化UBL3蛋白。有趣的是,在過表達Flag-UBL3細胞中,UBL3條帶出現彌散現象,并在樣品裝入SDS-聚丙烯酰胺凝膠電泳之前添加2-mercaptoethano(βME+)后信號消失。為了驗證UBL3修飾確實發生在體內,作者建立了UBL3敲除小鼠,并在腦組織(此組織UBL3高表達)中分析PTM,發現PTM表達下降。作者同時構建了UBL3C113/114突變,檢測發現不僅在MDA-MB-231細胞中,在每一個所檢測的細胞中UBL3均不表達。但在UBL3C113A和UBL3C114A突變體中,UBL3修飾表達雖降低但仍能檢測到其表達。
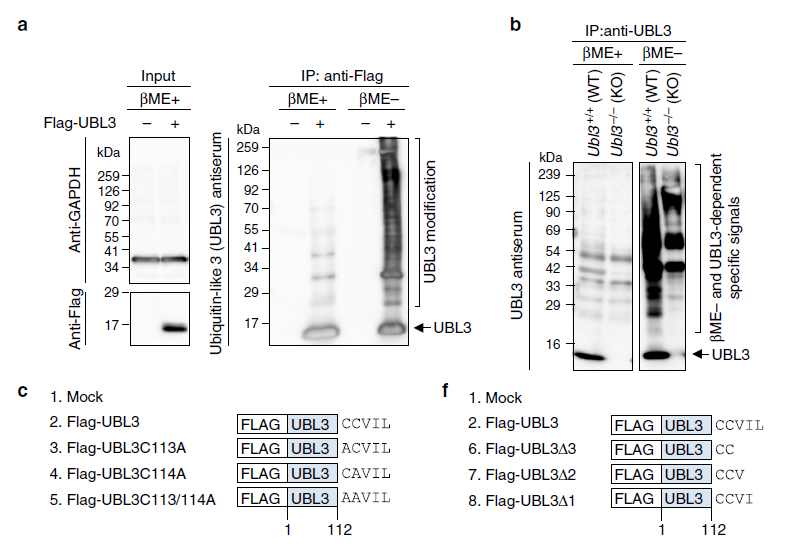
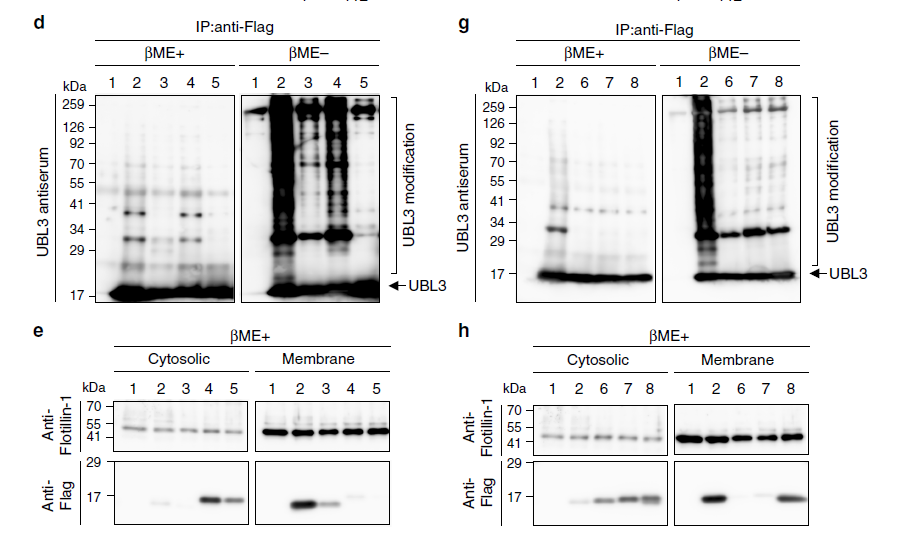
圖1 UBL3作為轉錄后修飾因子的分析
2. UBL3向MVBs和sEVs轉化過程中UBL3的修飾不可缺少
作者通過免疫熒光檢測UBL3的亞細胞定位,發現細胞質中UBL3修飾程度下降。接著構建UBL3加EGFP熒光,并與MVBs的標記物CD63進行融合分析,進一步驗證UBL3在MVBs多泡體中富集。為進一步證明MVBs多泡體中UBL3修飾與定位,作者檢測了UBL3C113A、UBL3C114A、UBL3C113/114A及UBL3△1與CD63融合分析,與野生型UBL3檢測不同,野生型的未見到與CD63融合。為了了解UBL3在多泡體及膜中的定位,作者又進一步安排了免疫電鏡檢測。將加了Flag標簽的UBL3質粒轉染進MDA-MB-231細胞后,UBL3在MVBs及質膜中表達清晰,在線粒體及核膜中未檢測到表達。其中UBL3△1主要定位于質膜,不在MVBs中。這些結果顯示UBL3修飾在MVBs形成中是必須的。
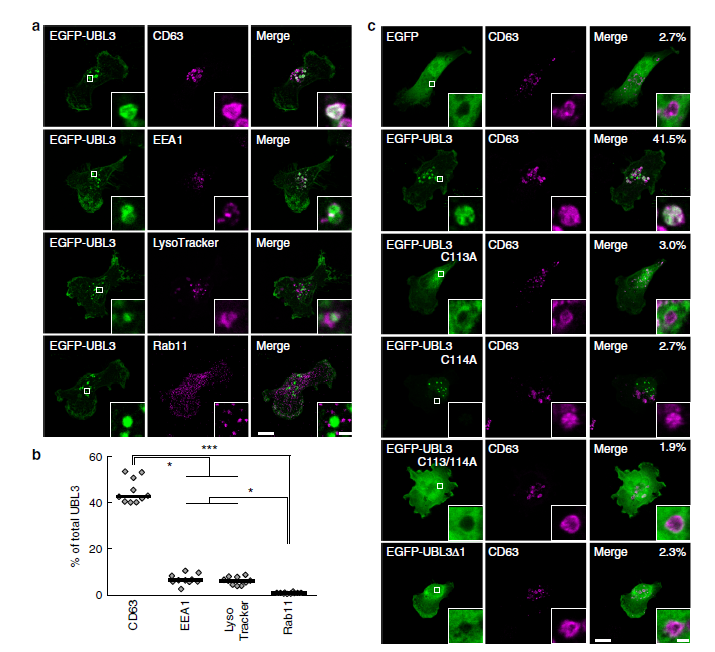
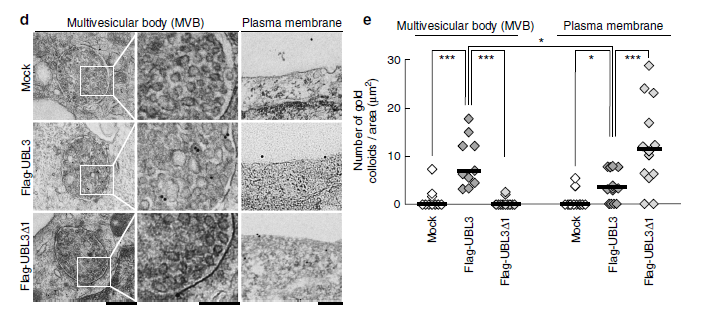
圖2 UBL3向MVBs轉化依賴UBL3修飾共定位檢測
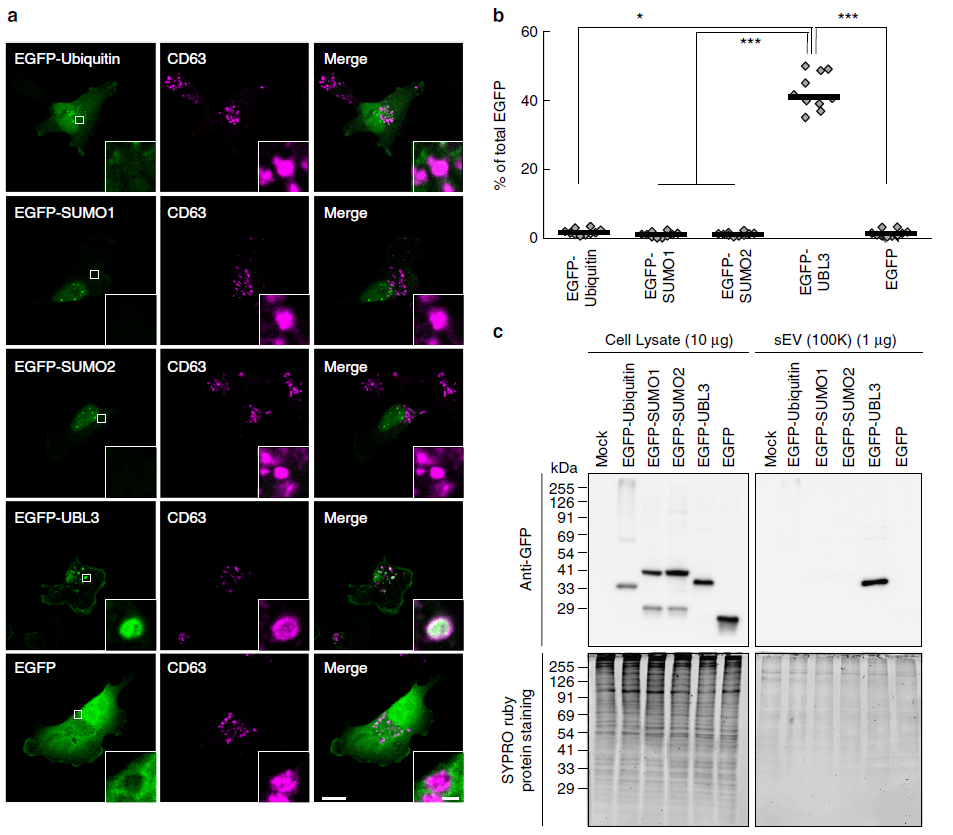
圖3 亞細胞定位及UBLs到外泌體的歸類
3. UBL3敲除小鼠中外泌體中總蛋白下降,UBL3修飾影響蛋白向胞外分泌
作者在前期的研究中發現,MVBs更多的傾向于分泌成胞外囊泡EVs,將MDA-MB-231細胞分泌上清分別在2000×g(2K)離心力、10000×g(10K)離心力及100000×g(100K)離心力下離心,發現在100k離心力下UBL3富集程度最高。通過對構建的UBL3敲除小鼠與正常小鼠進行蛋白質組學定量分析,發現UBL3敲除小鼠中外泌體總蛋白含量比野生型降低60%。
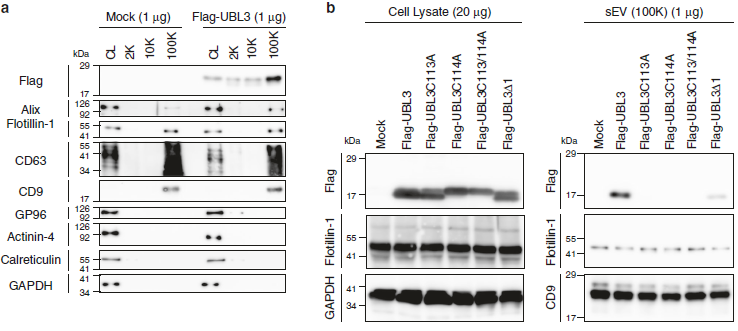
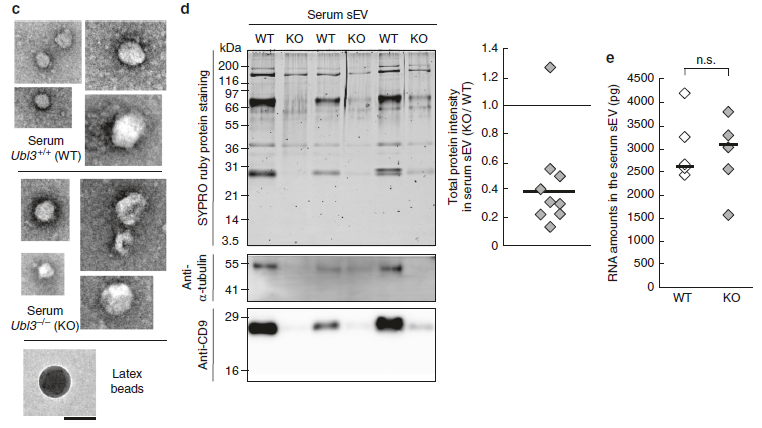
圖4 UBL3敲除小鼠中外泌體總蛋白量鑒定
為更好的了解UBL3修飾后其生理功能,作者進行了全面的蛋白質組學研究分析,UBL3互作蛋白依賴于兩個C端半胱氨酸殘基的方式。同時作者發現在與UBL3互作的蛋白中至少有22個與疾病相關的分子,包括與腫瘤形成、代謝、轉移等相關,例如HRAS、KRAS、TGFBR1、TGFBR2、RB1、ITGA6、ITGB4、mTOR、TSC2及APLP2。同時發現與免疫應答相關的分子mTOR、RPTOR及TSC2,Notch信號分子NOTCH1、NOTCH2、NOTCH3等。為檢測UBL3是否經外泌體形式引起受體細胞中Ras信號激活,作者將從經RasG12V轉染的MDA-MB-231細胞上清中提取的經PKH67包被的外泌體與細胞共孵育,檢測磷酸化ERK的表達情況,結果發現,相比于從UBL3C113/114A及RasG12V共轉染后提取外泌體孵育組,磷酸化的ERK(pERK)在經野生型UBL3及RasG12V共轉染后外泌體孵育組pERK表達明顯上調。UBL3修飾誘導了RasG12V到外泌體sEVs轉化過程中Ras信號的激活,UBL3作為一個類似于標簽的作用向sEVs傳遞蛋白。
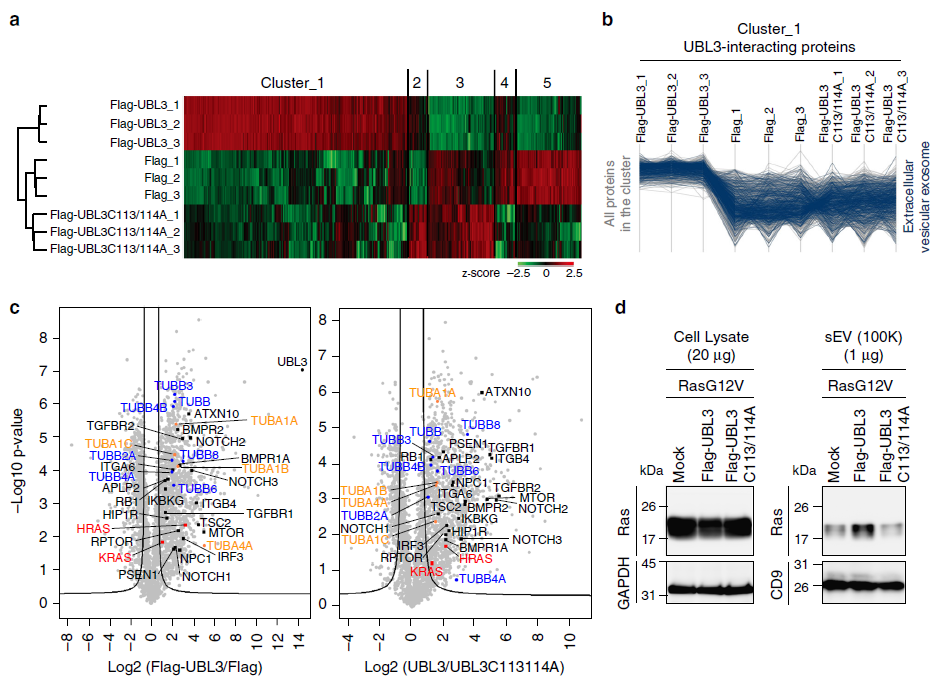
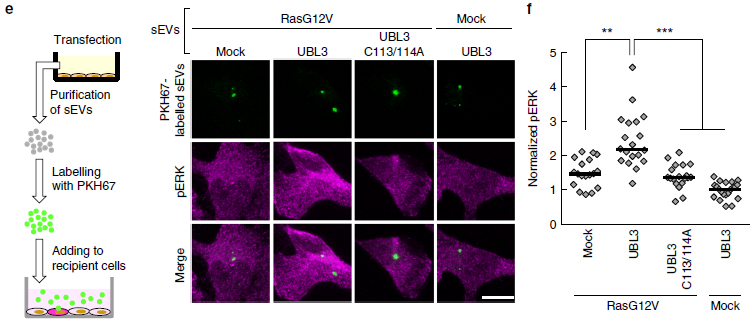
圖5 UBL3修飾影響蛋白到胞外分泌檢測
文章小結
1.通過研究數據表明UBL3通過C端半胱氨酸殘基二硫鍵結合靶蛋白,盡管UBL3有泛激素類似的區域,但UBL3修飾與傳統泛激素作用不同。
2. 作者證明了UBL3修飾在UBL3向MVBs及sEVs轉化過程中起重要作用。檢測到1241個與UBL3C端半胱氨酸殘基互作蛋白,其中29%被注釋為胞外泌體,同時發現UBL3敲除小鼠中外泌體蛋白總量降低60%,顯示UBL3極大可能參與過半的外泌體蛋白歸類過程。UBL3與特定蛋白的結合是短暫的,只有UBL3修飾后蛋白在細胞裂解過程中穩定存在。
3. 外泌體sEVs中的特異性蛋白在腫瘤的生長發生及轉移過程中其中重要的作用。本文中作者通過蛋白質組學確定了1241個依賴于兩個C端半胱氨酸殘基結合與UBL3互作的蛋白,其中包括了至少22個疾病相關分子,影響pERK磷酸化蛋白的表達。因此,抑制UBL3修飾可能成為與Sev相關疾病的治療靶點,具有潛在的影響。
解析文獻
Hiroshi Ageta, Natsumi Ageta-Ishihara et al. UBL3 modification influences protein sorting to small extracellular vesicles. Nature Communications, 2018, DOI: 10.1038/s41467-018-06197-y
參考文獻
1. Cox, J. & Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat. Biotechnol. 2008, 26, 1367–1372.
2. Gonzales, P. A. et al. Large-scale proteomics and phosphoproteomics of urinary exosomes. J. Am. Soc. Nephrol, 2009, 20, 363–379.
3. Peinado, H. et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET. Nat. Med. 2012, 18, 883–891.
4. Demory Beckler, M. et al. Proteomic analysis of exosomes from mutant KRAS colon cancer cells identifies intercellular transfer of mutant KRAS. Mol. Cell. Proteom. 2013, 12, 343–355.
5. Cox, J. et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Mol. Cell. Proteom. 2014, 13, 2513–2526.
6. Kowal, J. et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proc. . Natl Acad.Sci. U. S. A, 2016, 113, E968–E977.
外泌體在免疫中抗原呈遞、腫瘤的生長與遷移、組織損傷的修復等生理病理上起著重要的作用。同時,外泌體具有不用的組成成分和功能,可作為疾病診斷的生物標志物。
上一條:抗體應該如何保存
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










