染色質免疫沉淀(ChIP)實驗分析
信息來源:金開瑞 作者:genecreate 發布時間:2018-12-06 14:01:22
ChIP實驗被用來鑒定染色質相關蛋白的定位和/或它們的翻譯后修飾狀態。這種方法依賴于特異識別目的蛋白或修飾蛋白(例如組蛋白H3 Lys9甲基化)的抗體進行免疫沉淀和分析免疫共沉淀DNA。早期實驗方法依賴于使用溫和的裂解條件,以保護蛋白質--DNA相互作用,但這種方法只適用于和DNA直接結合的蛋白。甲醛交聯方法的使用使得這樣的分析可以擴展到與染色質關聯的幾乎任何蛋白。
非變性、非交聯免疫沉淀實驗
使用直接和特定DNA結合蛋白結合的抗體從細胞中分離蛋白質--DNA復合物依賴于抽提和免疫沉淀的條件,尤其是在該條件下怎樣使蛋白可溶并保持蛋白質-DNA的結合。有幾種方法已被成功使用,但是要注意到這一點,要根據蛋白質-DNA復合物所需的條件來調整實驗 條件。
該方法本質來說是利用低滲透壓裂解細胞,分離細胞核,在低鹽條件下使用核酸酶(DNaseI或微球菌核酸酶—Mnase)溶解染色質,接著使用抗體進行免疫沉淀識別目標蛋白。使用多肽可以從免疫復合物中最先洗下蛋白質-DNA復合物,這可以減少在更嚴格的洗脫下來的,與DNA非特異性結合的蛋白污染。提取的DNA可以克隆用于進一步分析、測序或用于探針陣列分析。
甲醛交聯免疫沉淀實驗
這已成為研究染色質中動態蛋白質--DNA的強有力方法。甲醛交聯的染色質免疫沉淀的實驗步驟見圖二。甲醛交聯使我們能夠檢測到可能不直接結合DNA的蛋白質--染色質的結合。這種交聯方法產生蛋白質-蛋白質、蛋白質-DNA和蛋白質-RNA交聯,因此適合于染色質不同成分以及瞬時關聯的分析。這也有效地被用于分析染色質翻譯后修飾的存在與否。這種方法最初在果蠅體系中是由Varshavski及其同事開發的,由Paro 修正的由兩個酵母小組廣泛使用和修正的。圖二該技術實驗步驟適用于所有的ChIP實驗,由于研究系統的不同或研究小組的偏好,在實驗細節上略有不同。此外,在新研究系統的第一次實驗需要優化實驗步驟。在下文我們將討論每一個步驟的一些細節,可能的修改和不同的版本。
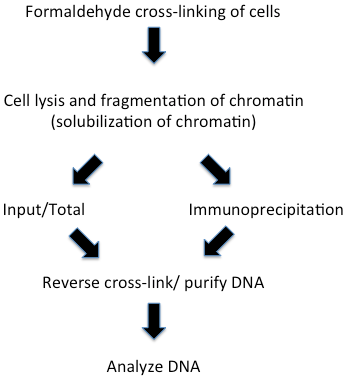
圖 1. 甲醛交聯和染色質免疫沉淀的綱要步驟
細胞交聯實驗步驟
有許多種可用于交聯反應的化學物質,但是甲醛具有多個優點而被廣泛使用。甲醛可溶于水,在大幅度的條件下(緩沖液,溫度等)具有活性。最重要的是,它能輕易地穿透生物膜,因此可以在完整細胞中進行交聯--這降低了在制備細胞和核提取物時產生復合物重定位的可能性。甲醛可直接加入到細胞生長的培養基中,或任何其他實驗材料(例如果蠅胚胎,解剖卵巢等),使其終濃度為1%即可。固定取決于時間和溫度,溫度越低固定速度越慢。典型的條件是在室溫下時不時攪拌15分鐘,但時間可以調整為在5分鐘至幾個小時之間。當希望快速固定時,固定終止是通過加入終濃度為0.125M的甘氨酸。甲醛處理的持續時間由給定的起始材料和目標蛋白的實驗情況決定,并且要考慮可溶染色質復原時間以保證不導致目標蛋白免疫學活性的喪失,例如抗原表位被屏蔽、隱藏,以至于不能進行長時間固定。對于那些難以檢測的蛋白來說,時間越短,溫度越低,甚至甲醛濃度更低可能可以緩解該問題。
| 步驟 | 優化項 | 參數改變 |
| 交聯/甲醛 | 通常不需要優化 |
時間:5分鐘到幾小時 溫度: RT - –4 ºC 甲醛濃度:1% - 0.4%。 |
| 細胞裂解 | 通常不需要優化 | 裂解緩沖液選擇:SDS-LB; FA-LB;或者其他。 |
| 染色質組分分級 | 依據需要優化 |
超聲: 超聲儀的選擇; 超聲持續時間;需要凝膠檢測片段大小。 MNase處理:時間和濃度 注意: 組分分級因裂解緩沖液不同而改變;使用特定的裂解緩沖液優化組分分級。 |
| 免疫沉淀 | 依據需要優化 | 抗體選擇;抗體孵育時間: 2h-過夜 |
| 解交聯/ DNA純化 | 不需要優化 | 解交聯步驟按標準來;純化: CsCl或者苯酚:氯仿提取;第二種方法更簡單并且效率高。 |
| DNA分析 | 根據選擇的方法進行優化 | 槽印跡(Slot blots,過時的); PCR; RT-PCR;平鋪陣列(Tiling Arrays);二代測序。 |
表.ChIP實驗步驟總結
細胞裂解和染色質片段化
細胞裂解和染色質片段化
裂解細胞和獲得可溶染色質緊密關聯的。依據不同的實驗材料對應需要一些額外的實驗步驟(例如,酵母 - 機械破損,果蠅胚胎 –去除卵殼)。在培養基和大多數其它物質中生長的細胞需要適當的裂解液重懸細胞和超聲處理。甲醛處理過的細胞非常難裂解,因此超聲處理這一步不僅需要更有效的裂解并且還需要染色質組分分級。作為超聲處理的替代,交聯的細胞核可以用微球菌核酸酶部分消化 。目前有兩個主要在用的裂解液系統 - SDS-緩沖系統和FA緩沖液。也有其他實驗步驟采用些許不同的緩沖液,但是這兩種是使用最廣的,而且在多個系統中被證明可以很好地使用。對于其他緩沖液,SDS緩沖具有許多優點 – 是超聲處理最有效的裂解緩沖液;染色質片段的大小分布變化小;背景少。這個緩沖液包含1%的SDS,在免疫沉淀實驗中則需要稀釋至0.1%。這個緩沖液條件適用于大多數,但不是所有的抗體。如果緩沖液條件由具體實驗決定(見下文),那么這個緩沖液不適合免疫沉淀實驗,FA裂解液則是一種很好的替代品。對于超聲來說,大多數可重復的結果是由BioRaptor完成的,染色質片段大小平均為∼300 bp 。染色質的片段化是至關重要的,因為片段化程度將影響后續實驗的分辨率。稍微有所不同的哺乳動物細胞裂解實驗步驟是由Farnham組研發的.
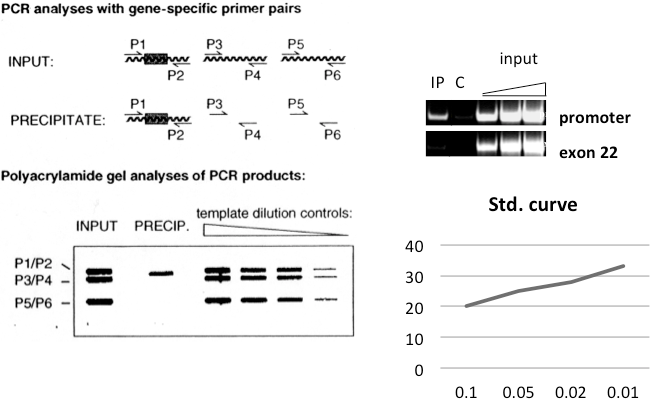
圖2. 共沉淀DNA PCR分析
該步驟中的關鍵因素是抗體選擇。如果這個抗體在ChIP實驗中沒使用過/顯示可以使用,采取預實驗是非常明智的。請注意,并不是所有公司銷售的“ChIP抗體”都可以用來進行ChIP實驗。免疫沉淀實驗中效果良好的抗體,可能在ChIP實驗中并不好用。一些抗體在0.1%SDS的環境下不能很好地發揮功能,而且免疫沉淀實驗需要在FA裂解緩沖液的條件下進行。單克隆抗體和合成小肽免疫的抗體可能可以或不可以很好地發揮功能,因為在交聯后抗原表位可能被屏蔽了;另一方面,這些抗體具有較高的特異性。一般的多克隆抗體,或者兩種或多種單克隆抗體的混合物也是可以嘗試的。一旦實驗確定該抗體可在交聯的條件下進行免疫沉淀,則需要測試在這些條件下的抗體特異性。這可以通過在實際ChIP實驗中引入陰性對照(免疫沉淀 RNAi處理的細胞,突變細胞,等等)來實現。如果能測定全基因組,那么結果就是特別真實可靠的。
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










