Molecular Cancer:蛋白質組學聯合多種分子檢測技術揭示CDH2以促進血管生成的方式促進肺腺癌的發生發展
信息來源:金開瑞 作者:genecreate 發布時間:2020-07-13 08:48:51
本期解讀
題目:Tumor endothelial cell-derived cadherin-2 promotes angiogenesis and has prognostic significance for lung adenocarcinoma
期刊:Molecular Cancer
影響因子:10.679
01、研究背景
肺癌是最常見的惡性腫瘤之一,嚴重威脅著人類的生命和健康。1971年,Folkman等提出了腫瘤生長依賴于血管生成的假說,當腫瘤直徑達到一定大小時,就會啟動“血管生成開關”,促進新的血管生成,以保證腫瘤生長的血供需求。腫瘤血管生成是一個極其復雜的過程,受多種血管生成因子的調控。因此,抑制血管生成過程中關鍵步驟,阻斷腫瘤血管生成,成為近年來肺癌治療的新策略。
文章通過iTRAQ-2DLC-MS蛋白質組學技術進行抗血管生成基因靶點篩選,選取肺癌組織癌及癌旁分離獲得的內皮細胞ECs作為研究材料,并經IHC免疫組化驗證最終確認血管鈣黏蛋白Cadherin-2(CDH2),其在肺癌中顯著上調。通過構建CDH過表達及干擾基于細胞水平對CDH2促血管生成功能進行研究,臨床數據結合顯示CDH2的高表達與腺癌(ADC)的腫瘤分期、肺胸膜轉移、ADC患者的總生存期降低有顯著相關性,而在鱗狀細胞癌(SCC)中無相關性。實驗證明CDH2在血管生成中的重要性,闡述了其在抗血管生成治療及作為腺癌(ADC)候選預后標志物的潛力。
02、研究內容及結果
1. 基于iTRAQ分析的EC蛋白表達譜
1.1 分離血管內皮細胞ECs標記物鑒定
作者從ADC肺癌臨床組織進行內皮細胞分離工作,并根據離癌組織遠近分別將所分離細胞命名為:TECA(癌組織分離血管內皮細胞)、PECA(癌旁組織分離血管內皮細胞)及NECA(正常組織分離血管內皮細胞)。并采用免疫熒光染色和流式細胞分析對獲取內皮細胞進行鑒定。結果如下圖所示:
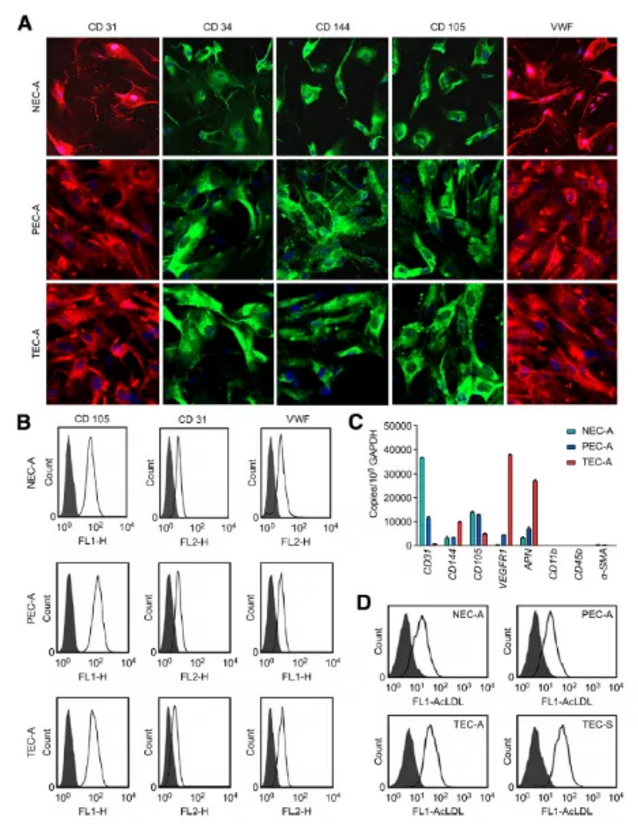
Figure1. 正常組織、癌旁及腫瘤來源的ECs中內皮細胞標志物的表達及AcLDL的攝取檢測
a. 免疫熒光檢測陽性:CD31(紅色標記)、CD34(綠色標記)、CD144(綠色標記)、CD105(綠色標記)、VWF(紅色標記),細胞核DAPI染色(藍色標記)
b. 流式細胞儀檢測ECs標記物(CD31、VWF)及微血管內皮細胞標記物(CD105)陽性
c. qPCR檢測CD105、CD31、CD144、VEGFR1、APN、CD11b及a-SMA基因基因表達水平
d. 流式檢測AcLDL內吞攝取(既往研究常以吞噬Dil標記乙酰化低密度脂蛋白能力作為鑒定EPCs的一個重要指標)
小結:分離正常組織、癌旁組織及肺癌腫瘤組織來源的血管內皮細胞經鑒定:CD31、CD34、CD144、CD105及VWF陽性(Figure1A所示),血管平滑肌標記a-SMA及單核細胞標記CD11b和CD45b陰性(Figure1C所示),AcLDL吞噬能力檢測陽性。
1.2 iTRAQ鑒定及功能檢測實驗
4組細胞樣品,NECA(正常組織分離血管內皮細胞)、PECA(癌旁組織分離血管內皮細胞)、TECA(惡性腺瘤癌組織分離血管內皮細胞)及TEC-S(鱗狀細胞癌組織分離血管內皮細胞)通過iTRAQ蛋白質組學檢測,經生物信息學分析共鑒定到1820個差異蛋白。文章通過對差異蛋白GO及KEGG富集分析(FigureS1),篩選出81個蛋白可能參與轉錄調控、蛋白組裝、NF-KB轉錄調控及過氧化氫分解代謝等生物學過程,并對4組樣品差異蛋白進行聚類熱圖分析及主成份分析(Fig2a&2b)。
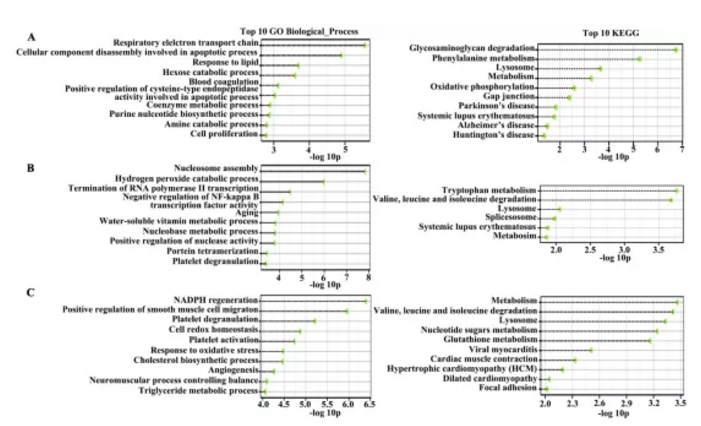
Figure S1:基因功能富集分析及Top10 pathway展示(GO及KEGG富集)
為進一步篩選確認與肺癌相關差異蛋白,作者將TECA及TECs組共有差異蛋白進行富集分析,并挑選出差異顯著性最大的15個蛋白用Western blotting方式進行差異驗證,結果如figS2所示,驗證結果顯示在肺腺癌(ADC)及肺鱗癌(SCC)中顯示差異蛋白表達趨勢相同。
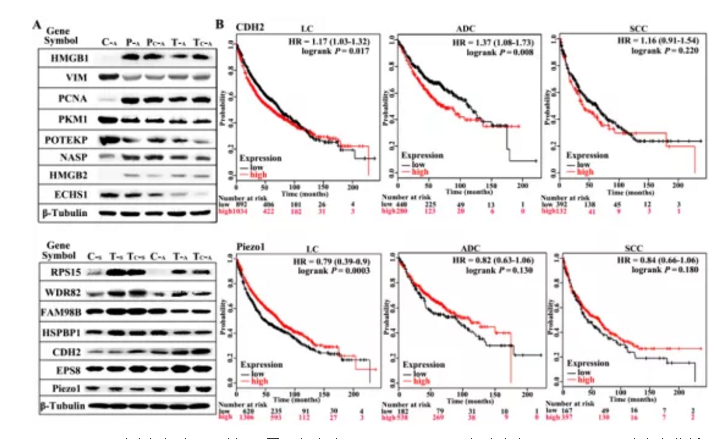
Figure S2. 肺癌組織中WB驗證不同蛋白表達及CDH2及Piezo1在肺癌中Kaplan-Meier 法生存分析
2. 不同肺癌類型來源血管內皮細胞ECs的異質性研究
2.1 Transwell檢測遷移
血管內皮細胞EC遷移和平滑肌細胞的正向調控是血管生成的兩個重要生物學過程。文章中通過設置不同類型的誘導培養基,研究正常血管內皮細胞(NEC)、ADC來源血管內皮細胞(TECA)及SCC來源血管內皮細胞(TECS)遷移速率變化,作者發現(Fig.2c):
(1)在包含20%或3%MVGS(血管生長因子添加劑)M131培養基培養條件下,TECA及TECS相較于NEC細胞遷移速率整體上要快(P<0.01)
(2)在腫瘤細胞培養基CM培養條件下,與TECs組相比,TECA組細胞遷移速率更快(P<0.01)
2.2 qPCR檢測Peizo1和CDH2表達
與ADC細胞系SPC-A-1共培養的原代人臍靜脈內皮細胞(HUVECs)中, Peizo1和CDH2的表達水平升高,而與SCC細胞系共培養的HUVECs細胞中Peizo1和CDH2的表達水平不升高(Fig.2d)。肺腺癌ADC臨床樣品相對于肺鱗癌SCC樣品IHC免疫組化陽性率更高(Fig.2e)。
小結:這些數據表明,CDH2在ADC的標記物開發中可能比SCC扮演更重要的功能角色。
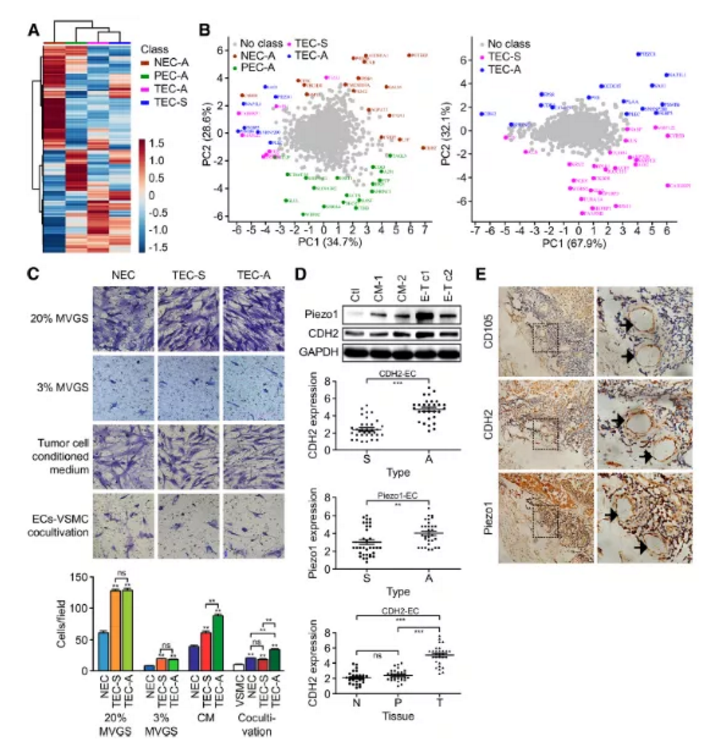
Figure 2. CDH2及Piezo1蛋白在ADC及SCC來源的血管內皮細胞中的表達模式及異質性研究
a. NECA、PECA、TECA及TECS樣品蛋白表達模式聚類分析,紅色代表蛋白上調,藍色代表下調
b. PCA主成份分析,主成份用相應的名稱和基因團顏色標記
c. 遷移實驗
d. ADC來源的血管內皮細胞及SCC來源的血管內皮細胞中CDH2及Piezo1基因表達異質性分析
e. 臨床肺癌患者(36例SCC,32例ADC)腫瘤內皮細胞中CD105、CDH2及Piezo1免疫組化檢測
3. CDH2對血管再生功能研究
為進一步研究CDH2在腫瘤生成過程功能,作者構建了CDH2過表達質粒及siCDH2干擾,經過表達及干擾效果驗證后,檢測其對血管生成相關指標進行檢測,結果顯示:過表達CDH2能顯著促進EC細胞增殖、遷移及血管生成;沉默CDH2基因表達后正好相反(Figure S3)。
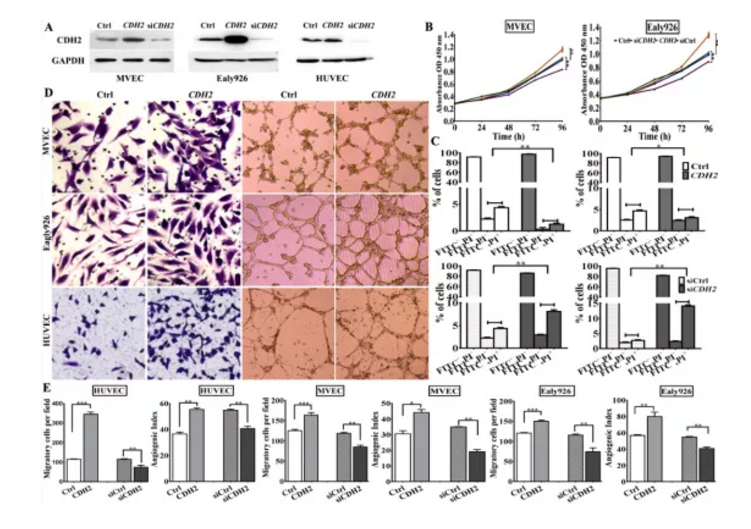
Fig S3. 過表達及干擾體外檢測CDH功能
a. Western blotting檢測CDH2過表達及干擾效果
b.&c. CDH2過表達及干擾后MEVCs及Ealy926細胞增殖及凋亡檢測
d&e. CDH2過表達及干擾后MEVCs、Ealy926及HUVEC細胞遷移遷移及體外血管生成活性檢測
4. CDH2對血管再生影響機制探討
CDH2過表達后,經Western blotting檢測發現:
(1)上皮細胞標志物(E-cadherin、EpCAM及P-cadherin)、神經和基底細胞粘附分子(NCAM-1、NrCAM和BCAM)、白細胞粘附分子(L-,E-,P-selectin)及特異性粘附分子(VE-caherin)均下調;
(2)遷移調控相關蛋白(RANTES、ENA-78、IL-6、MCP-2和IP-1a)也顯著下調;
(3)VEGFR信號通路中涉及到的3種蛋白(VEGFA、VEGFD及VEGFR3),發現其顯著上調
(4)磷酸化水平兩個主要MAPK信號通路蛋白ERK及MAPK及JNK顯著上調
小結:CDH2通過調控MAPK/ERK及MAPK/JNK信號通路相關蛋白變化進而促進血管生成
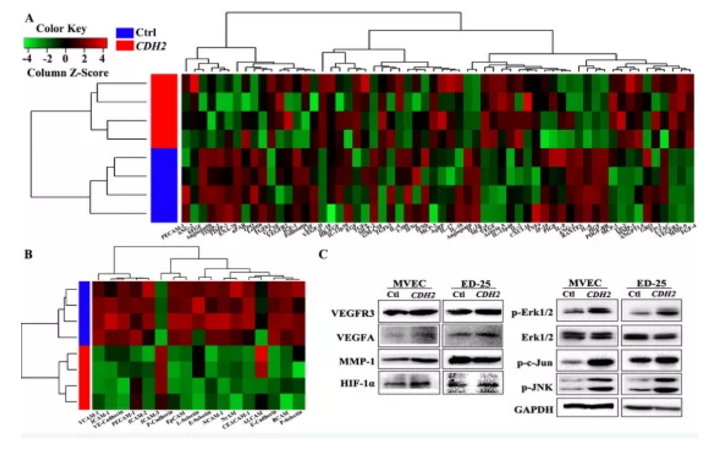
Figure S5. CDH2介導血管生成機制相關通路蛋白檢測
a&b. 篩選血管生成相關差異蛋白heatmap熱圖
c. Western blotting檢測通路相關蛋白
5. CDH2應用臨床價值評估
作者搜集臨床218例肺癌及鄰近對照組織進行IHC檢測,結果顯示臨床正常組織中CDH2表達較少,在肺癌組中腫瘤細胞中檢測呈現極強的陽性(Fig3a)。肺鱗癌SCC及肺腺癌ADC樣本中整體表達無明顯差異,但其在不同類型癌細胞中定位不同。通過IHC染色強度評估,進一步在細胞膜、細胞質和細胞核中進行表達分析發現,與鱗狀細胞癌SCC相比,ADC肺腺癌CDH2在細胞質及細胞核中的表達顯著提高(P<0.05)。
小結:CDH2裂解及表達的異質性導致了與癌細胞粘附和細胞遷移/增殖相關的不同調控行為。
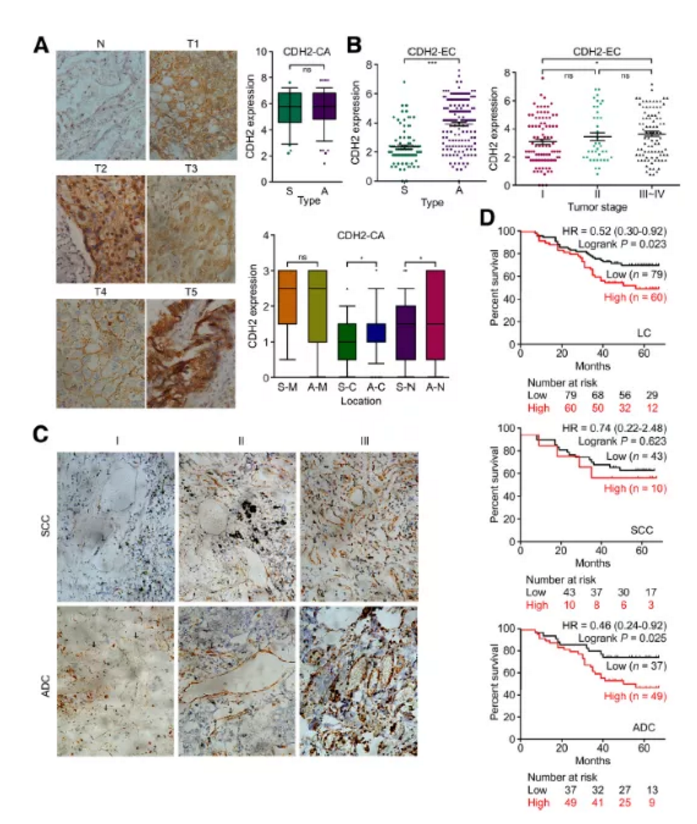
Figure3. IHC分析218例肺癌患者腫瘤組織中CDH2表達
a. IHC檢測正常組織及腫瘤癌組織CDH2表達
b&c. IHC檢測ADC及SCC癌組織中CDH2表達
d. 生存分析預測檢測分析
03、小結
文章闡明了ADC來源的血管內皮細胞ECs的蛋白組學特征,證實了在TECA(腫瘤來源內皮細胞)組中唯一上調的CDH2基因可促進體內外血管生成。MAPK/ERK及MAPK/JKN信號通路相關蛋白在CDH2誘導血管生成過程中起重要調節作用。進一步證實CDH2表達與腫瘤分期、肺胸膜轉移、ADC患者的生存預期相關,與SCC無關。研究數據為證實CDH2在血管生成重要作用及機制調控提供理論依據,證實其作為新的分子結合靶點標記物奠定基礎。
04、參考文獻
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394–424.
2. Liu YR, Guan YY, Luan X, Lu Q, Wang C, Liu HJ, Gao YG, Yang SC, Dong X,Chen HZ, Fang C. Delta-like ligand 4-targeted nanomedicine for antiangiogenic cancer therapy. Biomaterials. 2015;42:161–71.
3. Durr E, Yu J, Krasinska KM, Carver LA, Yates JR, Testa JE, Oh P, Schnitzer JE. Direct proteomic mapping of the lung microvascular endothelial cell surface in vivo and cell culture. Nat Biotechnol. 2004;22:985–92.
4. Zhuo H, Lyu Z, Su J, He J, Pei Y, Cheng X, Zhou N, Lu X, Zhou S, Zhao Y. Effect of lung squamous cell carcinoma tumor microenvironment on the CD105+ endothelial cell proteome. J Proteome Res. 2014;13:4717–29.
更多文獻解讀

蛋白質專題系列講座回放


05、金開瑞可提供
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










