分子互作專欄 | 蛋白-蛋白互作
分子互作是生命體的普遍主題,分子互作技術(shù)作為生命科學(xué)的基礎(chǔ)技術(shù)現(xiàn)已廣泛應(yīng)用于生命科學(xué)研究的方方面面。本文是分子互作專欄的第二篇文章,主題是“蛋白-蛋白互作”。
Co-IP原理
免疫共沉淀(Co-Immunoprecipitation,Co-IP)是以抗體和抗原之間的專一性作用為基礎(chǔ)的用于研究蛋白質(zhì)相互作用的經(jīng)典方法,常被用于鑒定特定蛋白復(fù)合物中的未知蛋白組分,是確定兩種蛋白質(zhì)在完整細胞內(nèi)生理性相互作用的有效方法。
其原理是:當細胞在非變性條件下被裂解時,完整細胞內(nèi)存在的許多蛋白質(zhì)-蛋白質(zhì)間的相互作用被保留了下來。如果用蛋白質(zhì)X的抗體免疫沉淀X,那么與X在體內(nèi)結(jié)合的蛋白質(zhì)Y也能沉淀下來。目前多用精制的protein A/G預(yù)先結(jié)合固化在瓊脂糖的磁珠上,使之與含有抗原的溶液及抗體反應(yīng)后,beads上的protein A/G就能吸附抗原達到精制的目的。
補充:Protein A、Protein G是最常應(yīng)用于抗體親和純化和免疫沉淀的蛋白。將Protein A、G分別固定在不同的介質(zhì)上,或同時將Protein A、G共價偶聯(lián)到介質(zhì)表面,是從腹水、細胞培養(yǎng)物上清和血清中分離IgG和IgG亞家族的有效工具。
將蛋白樣本Protein A和Protein G純化IgG,IgG片段和亞類的基礎(chǔ)是二者對IgG-類型的多克隆抗體和單克隆抗體具有很高的特異性親和力。
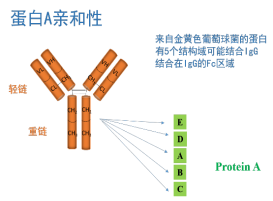
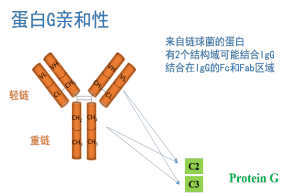
Protein A 和Protein G
Co-IP技術(shù)路線
1.Co-IP 前WB:提取樣本總蛋白,通過抗體檢測樣本中靶蛋白的表達水平,如果檢測到目的蛋白條帶,則進行IP實驗;
目的:驗證靶蛋白和互作蛋白在目標樣本內(nèi)是否表達;驗證抗體的特異性。
2.免疫沉淀:用靶蛋白對應(yīng)的IP級別抗體將靶蛋白從樣本總蛋白中富集下來
3.Co-IP后WB:對IP實驗的IgG和IP組進行WB鑒定,如果IP組能檢測到靶蛋白,而IgG組不能檢測到靶蛋白,則說明富集成功;
4.質(zhì)譜鑒定:在IP成功的基礎(chǔ)上,對IgG組和IP組進行銀染SDS-PAGE檢測,如果IgG組與IP組有明顯差異,則對IgG組和IP組的樣本進行質(zhì)譜鑒定。
Co-IP免疫共沉淀的優(yōu)缺點
優(yōu)點:
直接分析蛋白質(zhì)的相互作用:Co-IP可以通過特異性抗體選擇性地沉淀靶蛋白及其相互作用蛋白,從而直接研究它們的相互作用關(guān)系。
保留蛋白質(zhì)的生理環(huán)境:Co-IP通常在非變性條件下進行,能夠保留蛋白質(zhì)的天然構(gòu)象和生物活性,有利于研究生物過程中的蛋白質(zhì)相互作用。
高度特異性:通過使用特異性抗體,Co-IP可以選擇性地富集目標蛋白及其相互作用蛋白,降低非特異性結(jié)合的背景干擾。
可用于低豐度蛋白質(zhì)的分析:Co-IP可以有效富集低豐度的相互作用蛋白,增加對其研究的靈敏性。
結(jié)合其他技術(shù)應(yīng)用:Co-IP可以與其他技術(shù),如質(zhì)譜分析、Western blot等結(jié)合使用,進一步鑒定和驗證蛋白質(zhì)相互作用的特性。
缺點:
限于已知的相互作用關(guān)系:Co-IP需要事先知道靶蛋白及其相互作用蛋白的抗體信息,因此對未知的蛋白質(zhì)相互作用難以進行研究。
假陽性和假陰性:Co-IP在實驗過程中存在假陽性和假陰性的可能性,需要進行嚴格的對照實驗和數(shù)據(jù)驗證。
依賴特異性抗體的質(zhì)量:Co-IP的成功與否關(guān)鍵取決于抗體的特異性和親和力,因此需要確保使用高質(zhì)量的抗體。
技術(shù)復(fù)雜性:Co-IP需要一系列實驗步驟,包括免疫沉淀、洗滌、蛋白質(zhì)解析和檢測等,技術(shù)上較為復(fù)雜,需要經(jīng)驗豐富的實驗者進行操作。
Co-IP項目風(fēng)險點及解決方案
風(fēng)險點1:抗體非IP級別的或者抗體不能識別目標樣本所屬物種
解決方案:選用IP級別并且能夠識別目標樣本物種的抗體
風(fēng)險點2:拉取互作蛋白中沒有客戶想要的(第一有可能是拉下來了,但蛋白信號弱,在其他高峰度蛋白的信號掩蓋下,儀器未能識別到客戶所想蛋白)
解決方案:建議做WB直接進行驗證,看客戶所想蛋白是否在里面,WB會有信號放大作用,效果比質(zhì)譜鑒定進行篩選更合適些,質(zhì)譜只使用與廣篩;第二可以嘗試其他方式進行驗證,例如GST pull down,酵母雜交等不同方法多角度進行嘗試驗
風(fēng)險點3:外源轉(zhuǎn)入的蛋白在目標樣本中不表達
解決方案:盡量不要跨物種表達
風(fēng)險點4:標簽蛋白轉(zhuǎn)染細胞WB不能檢測到目的蛋白:
解決方案:推薦換標簽或者換較為容易轉(zhuǎn)染的細胞,另外盡可能的轉(zhuǎn)染與基因所屬物種最接近的細胞,避免物種間的排斥反應(yīng)引起的不表達。
Co-IP送樣指南
Co-IP實驗需要保證足夠的蛋白濃度才能維持原本存在的蛋白互作狀態(tài),尤其當?shù)鞍棕S度較低、相互作用力不強、使用蛋白不易提取的組織樣本等情況時。而且Co-IP的實驗條件往往需要反復(fù)摸索。因此用于Co-IP實驗需準備:
①細胞:Co-IP-WB細胞沉淀不少于80ul(至少2皿細胞量),Co-IP-MS細胞沉淀不少于100ul(大概4皿細胞),干冰寄送;
②動物組織:不少于0.5g,新鮮取材,干冰寄送;
③植物組織:不少于1g,新鮮幼嫩組織,干冰寄送
抗體用量要求:抗體≥30ul抗體/次
Q&A
1、Co-IP 實驗成功的評判標準是什么?
在Co-IP-WB鑒定結(jié)果中,IgG組無目的蛋白條帶、IP組有目的蛋白條帶,說明IP過程成功;銀染圖中,IP組對于IgG組有更多蛋白條帶、且存在差異,說明co-IP過程檢測到互作蛋白;IP產(chǎn)物在質(zhì)譜檢測中鑒定到的蛋白數(shù)量不能作為判斷實驗成敗的標準,因為這取決于目的蛋白本身所具有的互作蛋白數(shù)量、結(jié)合力強弱等方面。
2、IgG 組及IP 組均檢測到目的條帶,為什么?
如果遇到這種情況可能是在切膠及質(zhì)譜樣品處理過程中發(fā)生了串染,對IP組中互作蛋白的結(jié)論沒有影響,IgG組中的蛋白在文章中通常都不是考察對象。
3、Co-IP實驗成敗的主要因素?
a.所使用的抗體不僅需要優(yōu)秀的親和力、特異性,其識別表位還可能被互作蛋白所掩蔽(主要是使用單抗時);
b.當?shù)鞍谆プ黜毎l(fā)生在特定生理代謝條件、組織細胞類型之中時,co-IP實驗可能無法獲得互作結(jié)果;
c.如果誘餌蛋白和或捕獲蛋白在樣本中豐度很低時,會導(dǎo)致結(jié)果失敗;
d.兩個互作蛋白的親和力較弱;
e.當該蛋白互作需要較特定的離子強度,或者需要如Ca離子/Mg離子/ATP等輔因子時,要創(chuàng)造合適的反應(yīng)條件會變得困難;
f.一些樣品處理提取存在難度,提取足量目的蛋白與保持蛋白天然狀態(tài),需通過實驗條件達到優(yōu)化平衡;
最新動態(tài)
-
09.23
中藥的現(xiàn)代詮釋:外泌體如何革新傳統(tǒng)醫(yī)學(xué)?
-
07.02
1+1>2!深度解析RNA測序數(shù)據(jù)挖掘邏輯和后期實驗設(shè)計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學(xué)與美學(xué)的結(jié)合體:植物亞細胞定位技術(shù)詳解
-
06.28
“聚焦新質(zhì)生產(chǎn)力,激發(fā)科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(shù)(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經(jīng)“蛋白互作研究翹楚”BIFC!
-
05.14
轉(zhuǎn)染效率低、干擾效果差、重復(fù)性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術(shù)核心要點,讓“emsa” 秒變“easy”










