你還在做ChIP嗎?推薦使用CUT&Tag新技術
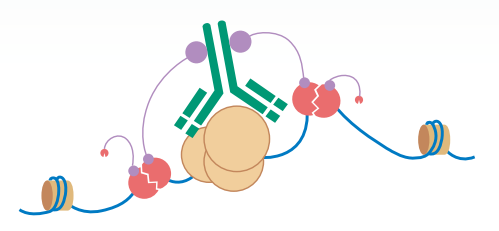
CUT&Tag(CleavageUnderTargetsandTagmentation),即靶向剪切及轉座酶技術,是?種利?酶錨定技術進??效、?分辨率的DNA測序?庫構建?法,也是替換傳統的ChIP-Seq?以研究蛋?質-基因組互作關系研究的新?法,屬于新?代超微量ChIPSeq技術。可?于檢測組蛋?、RNApolymeraseII和轉錄因?等具有DNA結合功能的蛋?種類,對表觀遺傳學、腫瘤和?細胞等領域的研究具有重要意義。
結合了ChIP-seq的優點和基于Tn5轉座酶的tagmentation?法,能夠快速、?效地鑒定染?質上蛋?質的結合位點。相較于傳統的ChIP-seq技術,Cut&Tag具有更快的實驗速度、更?的分辨率和更低的細胞輸?要求。
原理簡介
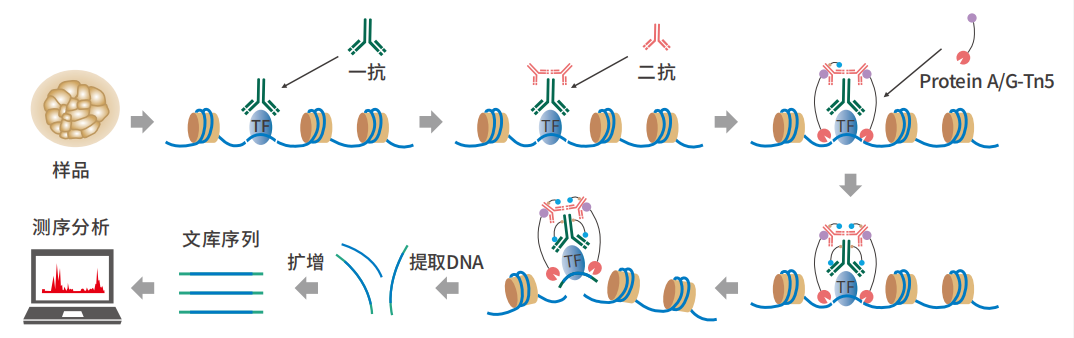
在抗體引導下,ChiTag酶僅在?的組蛋?修飾標志、轉錄因?、染?質調控蛋?結合染?質的局部進??的 DNA的?段化的同時添加測序接頭,并釋放到細胞外,?絕?部分?關的染?質還留在細胞核內,因?整個實驗的信噪??幅提?,同時簡化了實驗步驟。該?法可?管式?通量應?,并可與單細胞測序平臺「?縫」結合。ChiTag酶在打斷基因組的同時加上接頭,不需要繁瑣的補平加 A加接頭,在?天內可以完成從細胞到測序?庫制備全流程。
實驗流程
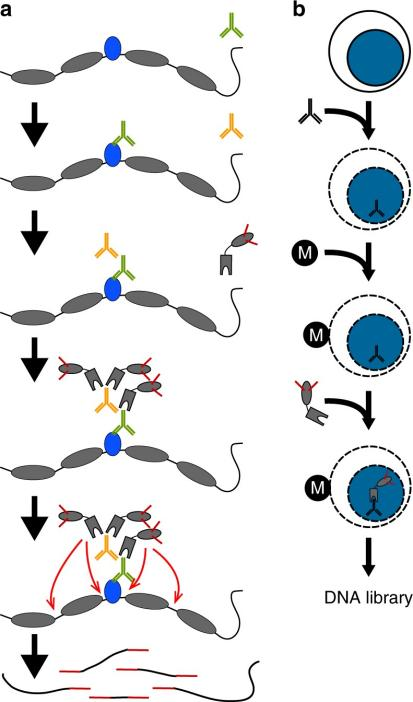
CUT&Tag技術優勢
01
無需甲醛交聯、去交聯、DNA打斷、標記,因此實驗周期更短
CUT&Tag實驗流程中,pA-Tn5酶的使用是一個重要創新[1],這種融合蛋白可以實現與二抗的互作,并能夠實現對目標區域的直接切割和標記,從而不再需要對細胞進行甲醛交聯和DNA片段化,可將整個實驗周期縮短至一天。
02
信噪比更高,細胞需求量大大降低
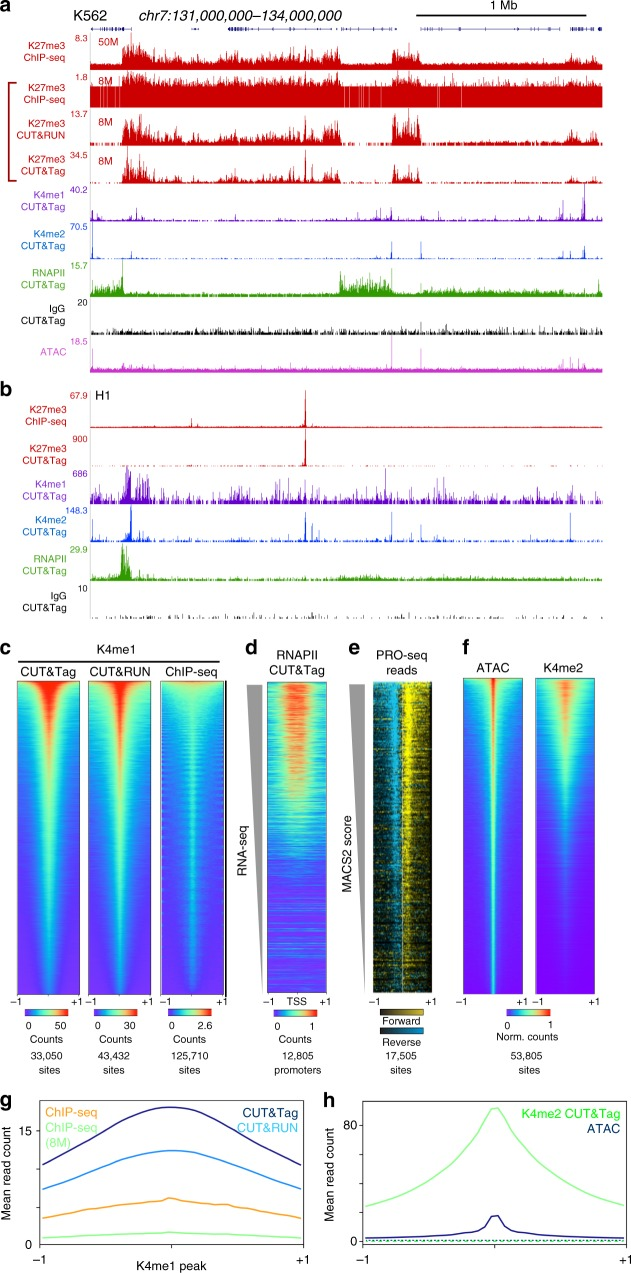
CUT&Tag在peak區域展示出遠高于ChIP-Seq和CUT&RUN的信號強度,且背景遠低于ChIP-Seq。同樣由于pA-Tn5酶的使用,CUT&Tag技術可同時完成對目標區域DNA的片段化和測序接頭添加,并將片段化產物釋放到細胞外。在此過程中,絕大部分非特異性染色質區域還留在細胞核內,因此整個實驗的信噪比大幅提高。
03
重復性好,信號富集強
由于整個實驗步驟的減少,相比于ChIP-seq和CUT&RUN,CUT&Tag在重復樣本之間表現出更高的數據相似度,可重復性高。相關性熱圖表明,對于H3K4me1這個標記,CUT&Tag的兩個重復樣品表現出更高的信號組內相關性;在測序數據量相同的情況下,CUT&Tag的peak region內數據量更多,信號更強。
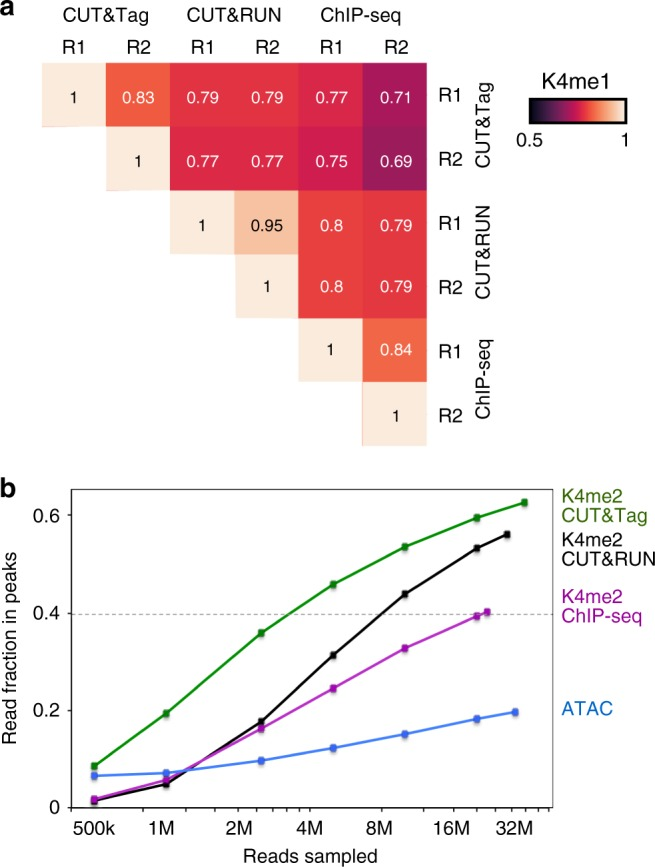
04
能對極少量細胞甚至單細胞進行分析
得益于pA-Tn5酶的高敏感性,CUT&Tag技術可在單細胞水平實現DPI的分析。
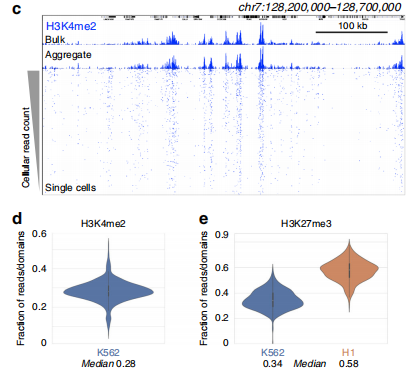
05
Peak在基因功能元件上的分布
為了進一步研究蛋白修飾的結合位點特征,理解蛋白修飾對基因調控的機制,統計peak在各基因功能元件分布個數,使用R包繪制peak在基因功能元件上分布餅圖和upset圖,比如基因功能元件分布在Promoter、5’UTR、3’UTR。
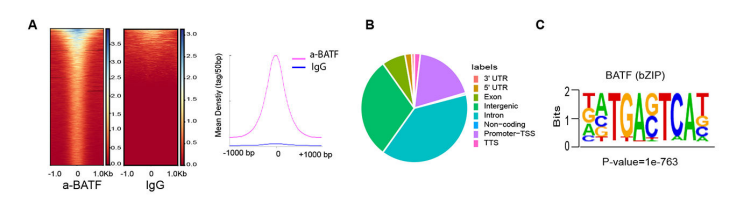
06
Motif分析
Motif 是具有某種生物特性,在一組相關序列中重復出現的序列模式,是研究基因表達調控機制的重要信息。CUT&Tag所研究的轉錄因子或組蛋白,其結合位點可能存在特定的序列特征。為嘗試得到這種修飾結合的保守序列信息(motif 序列),進一步理解蛋白修飾對基因表達的調控,選取call peak得到的summit上下游250bp的序列進行motif預測。
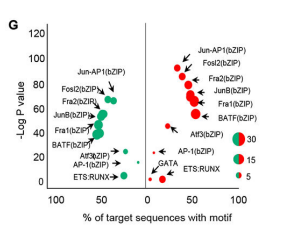
CUT&Tag是研究蛋白質與DNA相互作用的一種較新的分子生物學方法,與ChIP-Seq和CUT&RUN相比具有一些優勢,當然也會有一些局限性。
CUT&Tag技術的局限性
盡管CUT&Tag很有前景,但它確實存在一些局限性,可能會阻止它完全取代ChIP-Seq分析。
01
CUT&Tag的非交聯方案并不總是合適的
非交聯細胞不適合每項實驗。在最初的CUT&Tag文獻中,只測試了組蛋白修飾、NPAT和CTCF。許多轉錄因子表達不豐富,弱或短暫地與DNA結合,或間接地與染色質結合。在這些情況下,染色質交聯和超聲是檢測蛋白質-DNA相互作用的必要步驟。
此外,大多數經ChIP驗證的抗體可在交聯條件下工作,并且可能無法在非交聯條件下工作,因為交聯條件下的蛋白質表位的可識別性可能不同于天然條件。因此,從ChIP轉換到CUT&Tag需要徹底的抗體驗證,以確定抗體在不固定條件下的特異性和敏感性。
02
CUT&Tag仍然是新技術
雖然CUT&Tag似乎已經流傳了很久,而且很快就流行起來了,但它只是在2019年4月才首次發表。目前采用此項技術研究發表的文章也較少。
03
CUT&Tag可能會引入偏差
用于CUT&Tag的Tn5轉座酶對染色質開放區有很高的親和力。因此,CUT&Tag方法可能更適合于分析組蛋白修飾或與基因組活躍轉錄區域相關的轉錄因子,而不太適合分析沉默或含有異染色質的基因組區域。消化時間和pA-Tn5的使用量需要針對每個目標物進行仔細優化,以避免任何不特異的標記。
CUT&Tag是一種很有前途的技術,如果這種方法像ChIP-Seq那樣被廣泛采用,時間會告訴我們答案。像每一個新的方法一樣,所有的缺陷都還沒有被檢測出來,所以CUT&Tag的優化必須小心地進行,并且工作流程中的每一步都應該進行適當的質控。
技術應用
CUT&Tag技術對實驗室常規的模式生物和細胞系都有很好的適用性。這些模式生物包括人、動物、植物、微生物樣本。CUT&Tag技術在HepG2 cell、RAW246.7 cell、KYSE cell、Human primary cell、Human Tissure cell、hPSCs、K562 cell、mouse ES cell、HEK293T cell、mouse MEFs cell、mouse embryos cell、mouse brain cell、NIH3T3 cell、CD4+T cell、HeLa S3 cell、H1 hESCs cell、CD8+T cell、果蠅細胞、muscle stem cell、擬南芥、水稻、棉花等細胞樣本中已經得到了應用,可見,CUT&Tag技術對實驗室常規細胞樣本具有廣譜的適用性,含有細胞壁的細胞也適用。
金開瑞服務優勢
1、細胞起始量較低(單細胞-5*10^5 ),從百萬級降低到單細胞?平
2、結果可重復性較?,且信噪?較?
3、把繁瑣的ChIP流程縮短?1-2天的時間
4、操作流程簡單,?需甲醛交聯、細胞破碎和超聲?段化DNA
5、簡化了?庫構建流程,在轉座?上添加了‘接頭’,只需要簡單的PCR即可獲得?質量NGS?庫
6、與ChIP相?,測序深度減少10倍左右
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










