16分+SCI【客戶文章】Nature子刊:鞠懷強/徐瑞華團隊揭示FGL1促進轉移性結直腸癌免疫逃逸和進展的機制

摘要
結直腸癌(CRC)是全球范圍內第三大常見的癌癥,以及第二大癌癥死亡原因。在結直腸癌患者的病程中,約50%患者發生肝轉移,且預后不良,5年生存率低于20%。結直腸癌肝轉移(CRLM)患者通常無法從免疫療法中獲得足夠的益處,其潛在機制仍未被充分研究。在這里,我們發現纖維蛋白原樣蛋白1(FGL1)降低肝臟微環境中的抗癌免疫來促進CRC的進展。從機制上講,腫瘤相關巨噬細胞(TAM)通過在肝臟微環境中分泌TNFα/IL-1β激活NF-κB,并在轉錄水平上調OTUD1的表達,通過去泛素化增強FGL1的穩定性。破壞TAM-OTUD1-FGL1軸抑制了轉移性腫瘤的進展,并與免疫檢查點阻斷(ICB)療法協同作用。在臨床上,癌癥患者的高血漿FGL1水平能夠預測其預后不良,以及對免疫檢查點阻斷(ICB)療法的益處降低。芐索氯銨(Benzethonium chloride)是一種經FDA批準的防腐劑,能夠抑制FGL1的分泌,從而抑制了肝轉移性腫瘤的生長。總的來說,本研究揭示了FGL1在促進轉移性腫瘤進展中的關鍵作用和翻譯后的調節機制,突顯了TAM-OTUD1-FGL1軸作為癌癥免疫療法的潛在靶點。
研究思路

結果
FGL1通過肝臟微環境中的免疫抑制促進結直腸癌的進展
該研究首先通過構建小鼠結腸直腸癌(CRC)的肝轉移模型,發現在肝臟微環境中FGL1蛋白顯著上調。進一步的實驗證明,在CRC的肝轉移過程中,FGL1通過降低腫瘤浸潤T細胞,促進了腫瘤的生長。研究還揭示了FGL1通過與LAG-3結合,抑制抗腫瘤T細胞反應,從而在肝臟微環境中發揮免疫抑制的作用。此外,對FGL1的敲除顯著抑制了肝臟微環境中的腫瘤生長,提高了小鼠的整體生存率。綜合而言,這些發現揭示了FGL1通過在肝臟微環境中降低腫瘤浸潤的T細胞水平來促進轉移性腫瘤生長,為開發相關免疫治療策略提供了理論基礎。
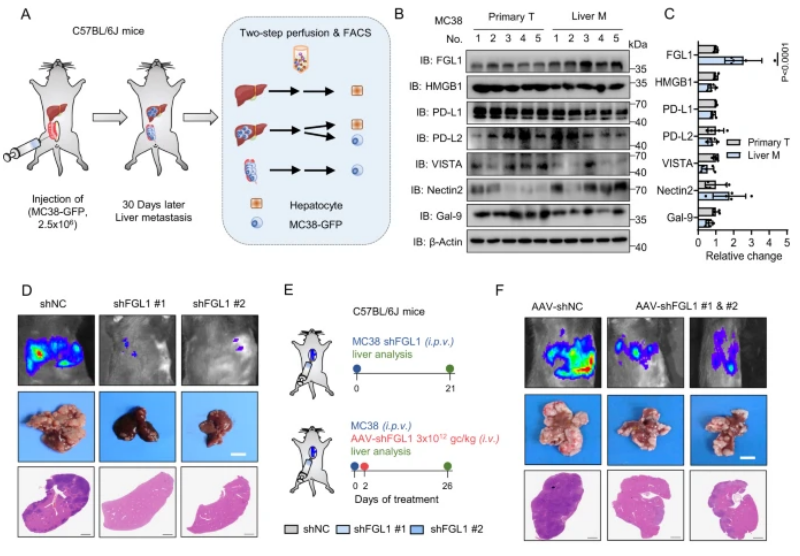
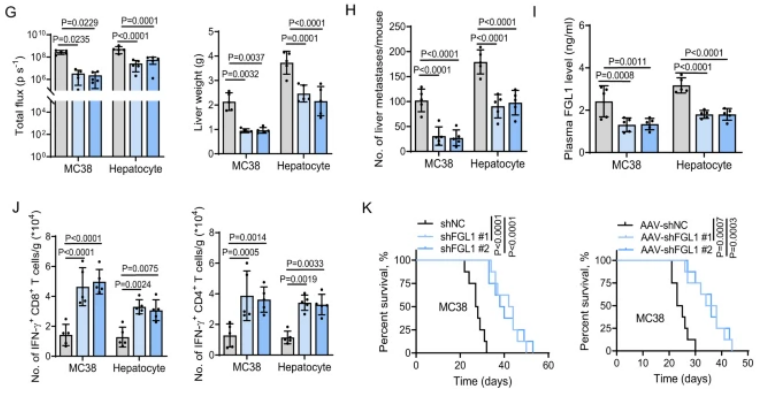
圖1:FGL1通過肝臟微環境中的免疫抑制促進結直腸癌的進展
A.構建小鼠CRC肝轉移模型,并使用FACS分選細胞。B.在MC38細胞中檢測了肝轉移腫瘤組織和原發性腫瘤組織中多種免疫抑制分子的表達,包括FGL1。C.使用ImageJ對免疫抑制分子的表達進行了定量估計。D.在C57BL/6 J小鼠中通過門靜脈注射對照組(shNC)和FGL1敲除MC38細胞,觀察了熒光圖像和H&E染色。E.展示了實驗策略,包括門靜脈注射和靜脈注射。F.通過對C57BL/6 J小鼠進行門靜脈注射MC38細胞并進行AAV-shNC或AAV-shFGL1(#1,#2)處理,觀察了熒光圖像和H&E染色。G.MC38細胞或肝細胞中FGL1敲除小鼠的熒光定量和肝重。H、I.MC38細胞和肝細胞中FGL1敲除小鼠的肝轉移灶數量和血漿FGL1水平的ELISA檢測。J.MC38細胞或肝細胞中FGL1敲除小鼠的肝轉移灶中T細胞數量的流式細胞術分析。K.各組小鼠的生存曲線分析。
高FGL1水平預示著不良預后,且從PD-1/PD-L1阻斷治療中獲益較少
高FGL1水平與結直腸癌、胃癌和食管鱗狀細胞癌患者的不良預后以及在PD-1/PD-L1阻斷治療中的較少臨床益處相關。通過分析組織微陣列(SYSUCC),我們發現FGL1在腫瘤組織中表達上調,并在肝轉移組織中顯著增加。與健康人相比,患者的血漿FGL1水平升高,而有肝轉移的患者水平更高。Kaplan–Meier生存分析顯示,較高的血漿FGL1水平與不良預后相關。此外,高血漿FGL1水平與結直腸癌或胃癌患者在PD-1/PD-L1治療中的較差反應有關。在不同治療隊列中,血漿FGL1水平的升高與免疫治療的不利效果呈負相關。綜上所述,高血漿FGL1水平可能是肝轉移患者PD-1/PD-L1阻斷治療中臨床效果不佳的預測指標。
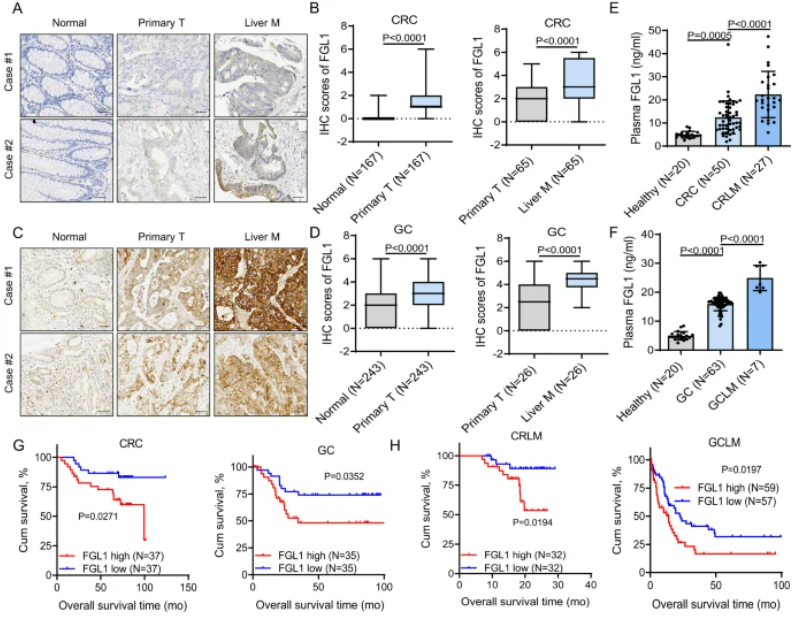
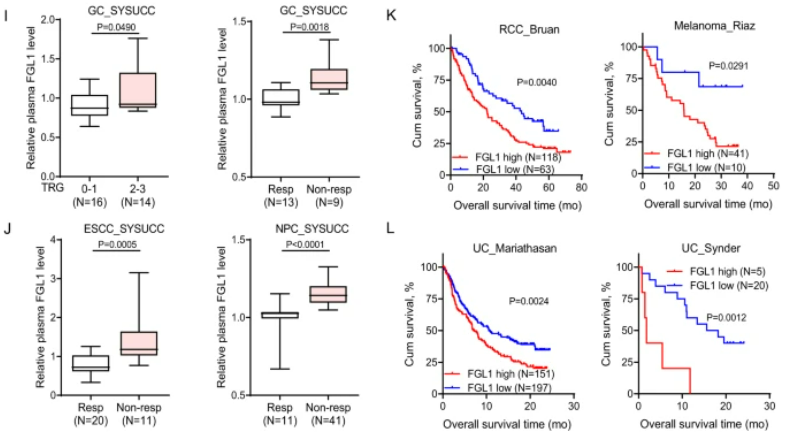
圖2:高FGL1水平預示著不良預后,且從PD-1/PD-L1阻斷治療中獲益較少
A . 在正常組織、原發性CRC腫瘤和相配對的肝轉移組織中的FGL1免疫組織化學染色。B. FGL1的IHC染色評分。C. 在正常組織、原發性GC腫瘤和相配對的肝轉移組織中的FGL1 IHC染色。D. FGL1的IHC染色評分。E、F. 通過ELISA檢測了健康供體、CRC、CRLM、GC和GCLM患者的血漿FGL1水平。G. Kaplan-Meier分析了CRC和GC患者的血漿FGL1水平與總生存期的關系。H. Kaplan-Meier分析了CRLM和GCLM患者的血漿FGL1水平與總生存期的關系。I、J. 在多個癌癥隊列中,血漿FGL1水平與抗PD-1治療的效果呈負相關。L. FGL1表達與接受抗PD-L1治療的患者總生存期呈負相關。
TAMs通過激活肝臟微環境中的NF-κB促進FGL1的穩定
在CRC肝轉移腫瘤中,我們觀察到明顯改變的腫瘤免疫微環境,尤其是巨噬細胞的顯著富集。為了確定TAMs是否參與了肝轉移腫瘤中FGL1的過表達,我們分離了來自小鼠及患者LM組織的TAMs,并將其與癌細胞間接共培養。實驗證實,TAMs顯著增加了CRC細胞中FGL1蛋白的表達,而FGL1的mRNA表達水平未受影響。進一步研究發現,TAMs分泌的TNFα和IL-1β通過轉錄后調控途徑上調了FGL1蛋白表達,該效應可以通過向與TAMs產生的條件培養基(TAM-CM)孵育的MC38細胞中添加中和抗體來挽救。我們進一步揭示了TAMs通過激活NF-κB/p65信號通路來降低FGL1的泛素化,從而增強其穩定性。最后,我們發現敲除p65減弱了TAM介導的FGL1穩定性,與NF-κB活性降低相一致。這些發現揭示了TAMs在肝臟微環境中通過調控FGL1的穩定性,促進CRC肝轉移的機制,為肝轉移癌的免疫治療提供了新的見解。
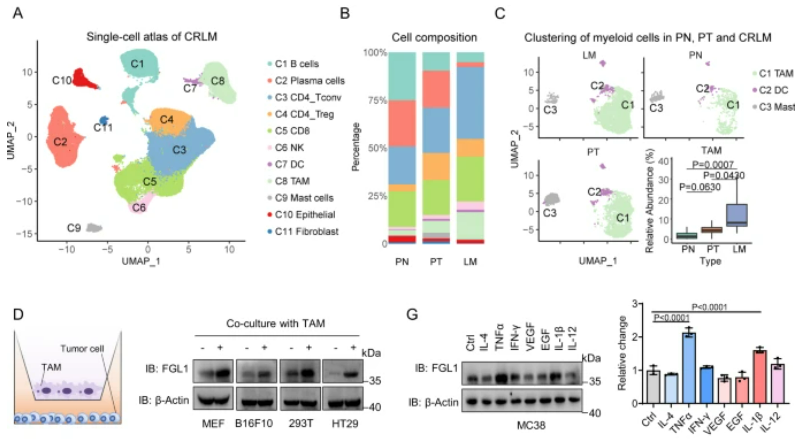
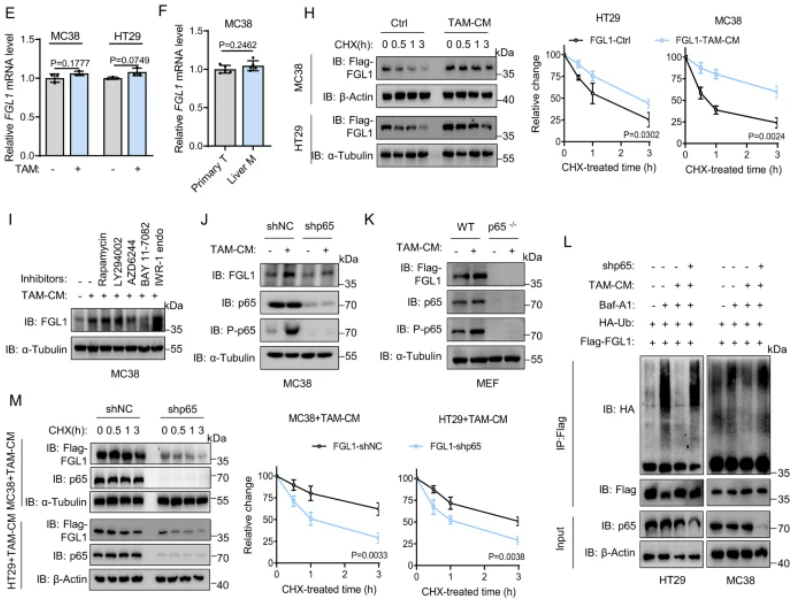
圖3:TAMs通過激活肝臟微環境中的NF-κB來促進FGL1的穩定
A.以前發表的CRLM單細胞圖譜的UMAP嵌入。B. 堆疊條形圖顯示在原發正常組織(PN)、原發腫瘤組織(PT)和肝轉移組織(LM)中每個簇的細胞比例。C. UMAP嵌入圖展示了在PN(n=10)、PT(n=10)和LM(n=10)中的髓細胞相對豐度。D. 與TAMs共培養16小時后,指定細胞中FGL1表達的IB檢測。E. 在與TAM共孵育的指定細胞中進行的FGL1 mRNA水平的qRT-PCR分析。F. qRT-PCR分析從原發和肝轉移腫瘤組織中分選的MC38細胞的FGL1 mRNA水平。G. IB檢測和定量,檢測了在給予10 ng/mL的指定細胞因子刺激后,MC38細胞中FGL1的表達。H. 對指定細胞進行IB檢測和定量,以檢測在給予40 μg/mL CHX處理,TAM-CM共培養后FGL1的表達。I. 在使用TAM-CM孵育的MC38細胞中,經過1小時與指定抑制劑處理的FGL1表達的IB檢測。J. 在與TAM-CM孵育的指定細胞中進行的FGL1表達的IB檢測。K. 在WT或p65−/− MEFs中過表達Flag-FGL1后,在與TAM-CM孵育后進行的Flag-FGL1表達的IB檢測。L. 在使用Baf-A1預處理并經過TAM-CM處理的指定細胞中進行的HA-Ub與Flag-FGL1相互作用的免疫共沉淀分析。M. 在指定細胞中進行的Flag-FGL1表達的IB檢測和定量。
去泛素化酶 OTUD1參與TAM介導的FGL1的穩定
通過質譜鑒定,我們發現去泛素化酶OTUD1參與了TAM介導的FGL1蛋白去泛素化和穩定過程。在293T和MEF細胞中,我們通過免疫共沉淀實驗證實了OTUD1與FGL1的直接相互作用。通過GST Pull-down實驗,我們進一步證實了重組His-OTUD1與GST-FGL1之間的直接相互作用。OTUD1的敲除顯著增加了MC38和HT29細胞中FGL1的泛素化和降解,反之亦然。此外,OTUD1的下調取消了TAM介導的FGL1去泛素化并減少了TAM誘導的FGL1穩定。半衰期分析顯示,OTUD1的下調減緩了在TAM-CM培養的腫瘤細胞中FGL1的蛋白半衰期。結果表明,OTUD1參與了TAM介導的FGL1穩定和免疫逃逸。
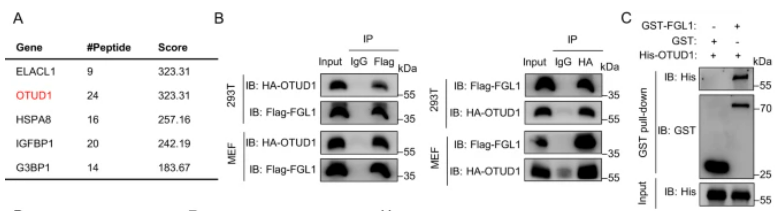
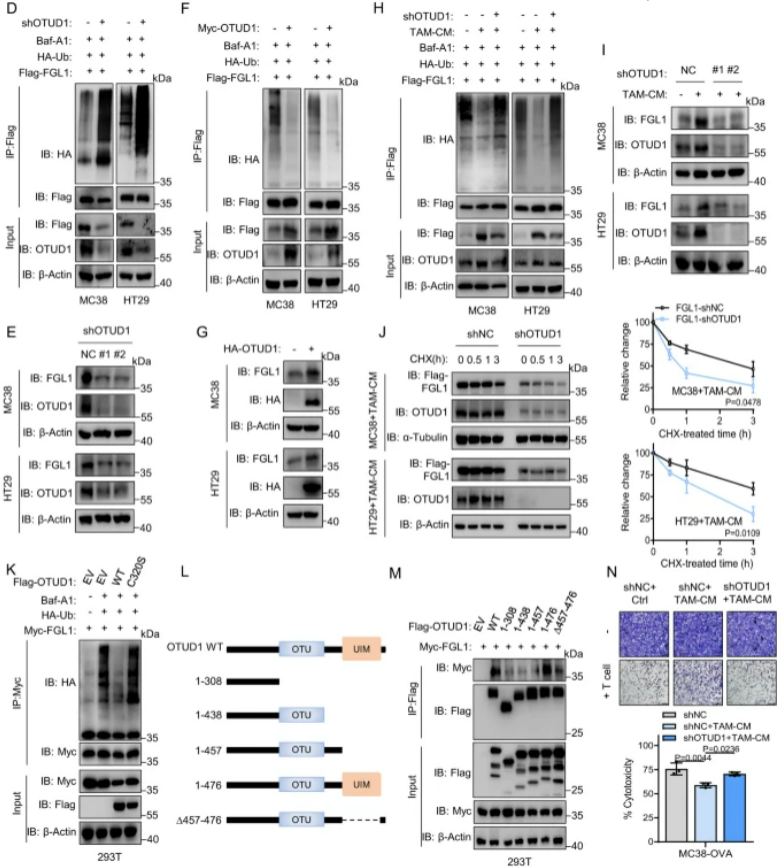
圖4:去泛素酶OTUD1參與TAM介導的FGL1的穩定
A. 利用質譜分析揭示了與TAMs共培養的293T細胞中FGL1結合的不同蛋白質,鑒定并驗證了去泛素酶OTUD1。B. 在293T和MEF細胞中,通過免疫共沉淀實驗驗證了HA-OTUD1和Flag-FGL1的直接相互作用。C. GST Pull-down證實了重組His-OTUD1和GST-FGL1蛋白的結合。D. 在OTUD1敲除或對照的MC38和HT29細胞中,預處理Baf-A1后,通過免疫共沉淀分析HA-Ub和Flag-FGL1的相互作用。E. 檢測了指示細胞中FGL1和OTUD1的表達。F. 在Myc-OTUD1過表達或對照的MC38和HT29細胞中,預處理Baf-A1后,通過免疫共沉淀分析HA-Ub和Flag-FGL1的相互作用。G. 檢測了指示細胞中FGL1和HA-OTUD1的表達。H. 在指示細胞中,預處理Baf-A1后,然后在TAM-CM中培養16小時,通過免疫共沉淀分析HA-Ub和Flag-FGL1的相互作用。I. 檢測了指示細胞中FGL1和OTUD1的表達。J. 在指示細胞中,培養在TAM-CM中16小時后,加入CHX不同時間,通過免疫印跡檢測和定量FGL1的表達。K. 在過表達Flag-OTUD1、Flag-OTUD1(C320S)或對照的293T細胞中,通過免疫共沉淀分析HA-Ub和Myc-FGL1的相互作用。L. 展示了OTUD1的結構示意圖。M. 在293T細胞中,通過免疫共沉淀分析不同Flag-OTUD1截斷體與Myc-FGL1的相互作用。N. 經活化的OT-1 T細胞與指示細胞共培養8小時后進行結晶紫染色的圖像和定量結果。
文中 Purifed GST FGL1 protein、Purified His-OTUD1 protein由金開瑞提供蛋白表達技術服務
OTUD1通過TAM/NF-κB信號通路轉錄上調
該研究表明,腫瘤相關巨噬細胞(TAMs)通過激活NF-?B/p65信號通路提高FGL1的穩定性,同時去泛素化酶OTUD1參與了TAM介導的FGL1的穩定過程。研究還揭示了NF-?B/p65與OTUD1之間存在內在的相互調控關系。NF-?B/p65作為轉錄因子在炎癥和免疫等過程中發揮關鍵作用,通過TCGA和CCLE數據庫分析及實驗證實,OTUD1的mRNA表達與p65表達呈高度正相關。ChIP-seq數據顯示OTUD1啟動子區域含有p65結合位點,Luciferase報告基因實驗證實了p65對OTUD1啟動子的調控作用。通過ChIP-PCR進一步證明了p65在OTUD1啟動子區域的結合,而且磷酸化的p65過表達顯著增加了OTUD1啟動子的活性。總體而言,這些結果表明TAMs通過NF-?B/p65激活轉錄上調OTUD1,揭示了NF-?B/p65和OTUD1之間的相互調控關系。
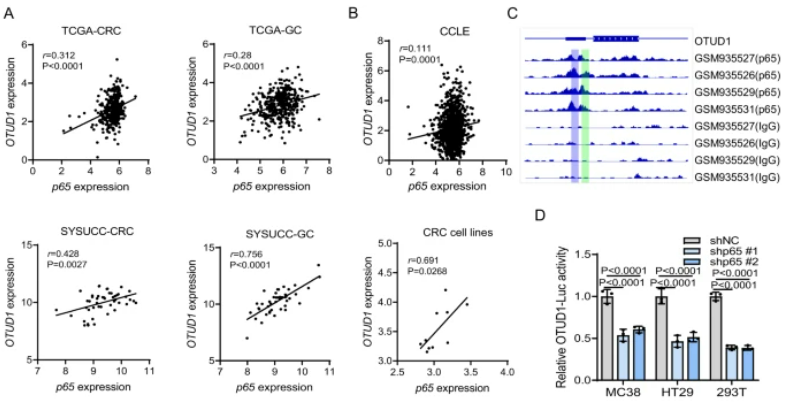
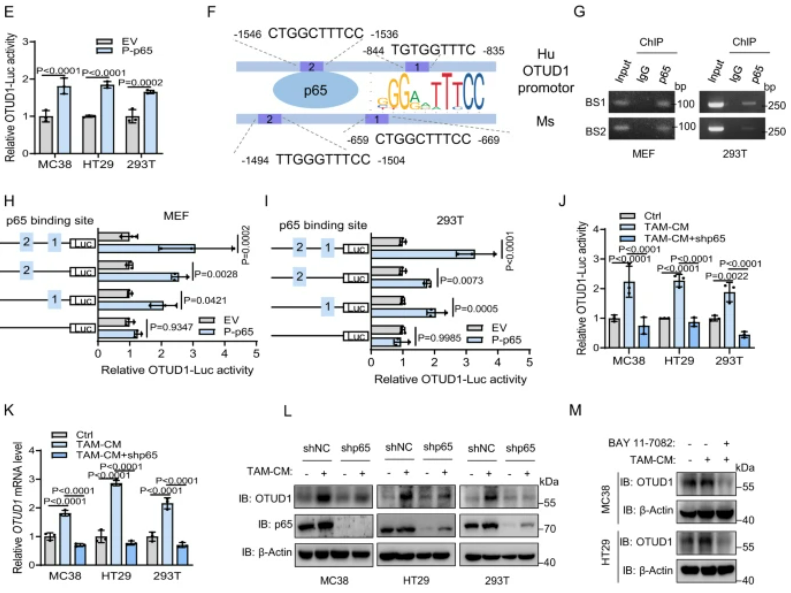
圖5:OTUD1通過TAM/NF-κB信號通路轉錄上調
A. 在TCGA-CRC和TCGA-GC數據集以及SYSUCC數據中,顯示了p65和OTUD1在CRC和GC患者中的表達正相關。B. 在CCLE數據集和CRC細胞系中,p65和OTUD1的表達呈正相關。C. 利用ChIP-seq數據顯示了OTUD1基因座附近p65的信號。D. 敲除p65降低了MC38、HT29和293T細胞中OTUD1啟動子報告基因的活性。E. P-p65過表達增加了MC38、HT29和293T細胞中OTUD1啟動子報告基因的活性。F. 人和小鼠OTUD1啟動子含有p65結合位點。G. ChIP-PCR分析驗證了MEFs和293T細胞中p65與OTUD1啟動子的相互作用。H、I. P-p65過表達增加了MEFs(H)和293T細胞(I)中OTUD1啟動子報告基因的活性,該效應通過突變p65結合位點得到減弱。J. 敲除p65降低了MC38、HT29和293T細胞中TAM-CM誘導的OTUD1啟動子報告基因的活性。K. 敲除p65減少了MC38、HT29和293T細胞中TAM-CM誘導的OTUD1 mRNA水平。L. TAM-CM處理后,MC38、HT29和293T細胞中OTUD1和p65的蛋白水平。M. 使用BAY 11–7082阻斷了MC38和HT29細胞中TAM-CM誘導的OTUD1上調。
TAM/TNFα-OTUD1-FGL1軸促進CRLM的免疫逃逸和進展
該研究發現在肝轉移的腫瘤微環境中,腫瘤相關巨噬細胞(TAM)通過激活TNFα-OTUD1-FGL1信號軸,增強FGL1的穩定性,從而促進了肝轉移的進展。實驗結果顯示,TNFα誘導的肝轉移過程中,FGL1的過度表達與免疫逃逸和腫瘤進展相關,而通過干擾這一信號軸可以抑制轉移性腫瘤的發展并激活抗腫瘤免疫應答。在人類結直腸癌肝轉移組織中,高FGL1水平與免疫抑制相關,低FGL1水平則與更強的抗腫瘤免疫反應相關。這一研究結果揭示了TAM/TNFα-OTUD1-FGL1軸在肝轉移的腫瘤微環境中的關鍵作用,為未來癌癥免疫治療的發展提供了重要線索。
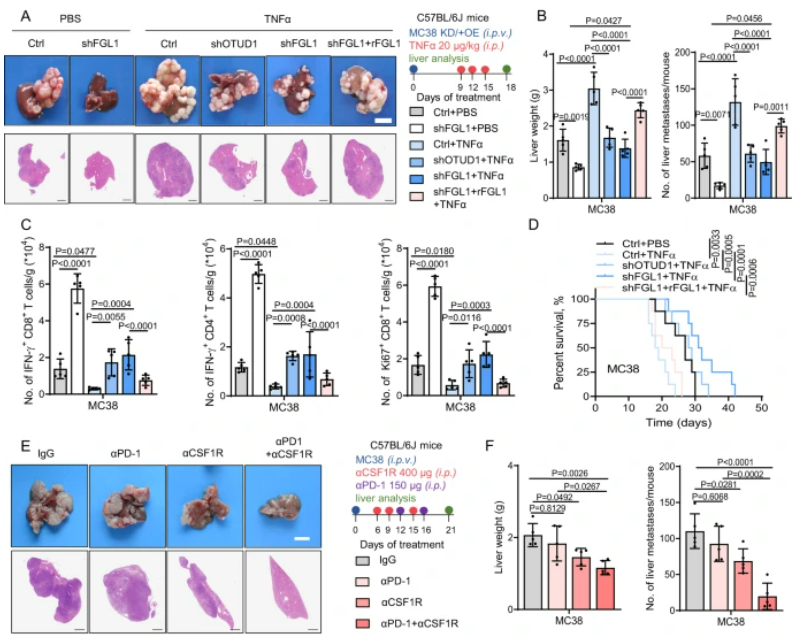
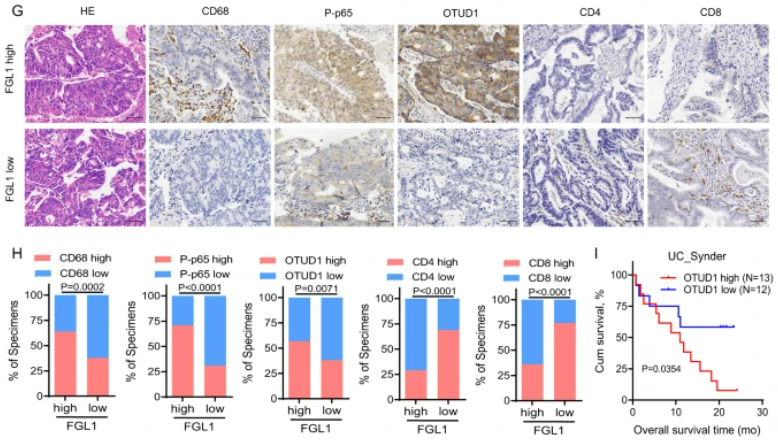
圖6:TAM/TNFα-OTUD1-FGL1軸促進結CRLM的免疫逃逸和進展
A. C57BL/6J小鼠接受幾種不同處理的MC38細胞門靜脈注射,給予TNFα處理后進行肝轉移組織的H&E染色。圖右顯示實驗策略。B. 統計每組小鼠的肝重和肝轉移灶數量。C. 流式細胞術分析各組小鼠肝轉移組織中IFN-γ+ CD8+、IFN-γ+ CD4+和Ki67+ CD8+ T細胞的數量。D. 繪制各組小鼠的生存曲線。E. 圖示C57BL/6J小鼠接受MC38細胞門靜脈注射后,并接受不同抗體的處理,進行的肝轉移組織H&E染色圖。圖右顯示實驗策略。F. 統計每組小鼠的肝重和肝轉移灶數量。G. 對高或低血漿FGL1水平的結直腸癌(CRC)患者進行肝轉移組織H&E和IHC染色。H. 高或低血漿FGL1水平組中,CD68、P-p65、OTUD1、CD4和CD8表達的百分比。I. OTUD1在接受抗PD-L1治療的患者總生存率中的相關性。
芐索氯銨通過減少FGL1的分泌抑制肝臟微環境中腫瘤細胞的進展
我們篩選了1430種FDA批準的藥物,發現芐索氯銨顯著抑制了FGL1的分泌,而且對腫瘤細胞的活力幾乎沒有影響。芐索氯銨治療通過降低癌細胞中的FGL1蛋白表達,有效減少了小鼠模型中的轉移性腫瘤負擔,而且與抗PD-1療法協同作用,顯著增強了免疫細胞在腫瘤微環境中的活性,延長了小鼠的生存期。總的來說,這些數據表明芐索氯銨和抗PD-1療法的聯合應用在治療肝轉移性腫瘤中可能具有潛在的臨床意義。
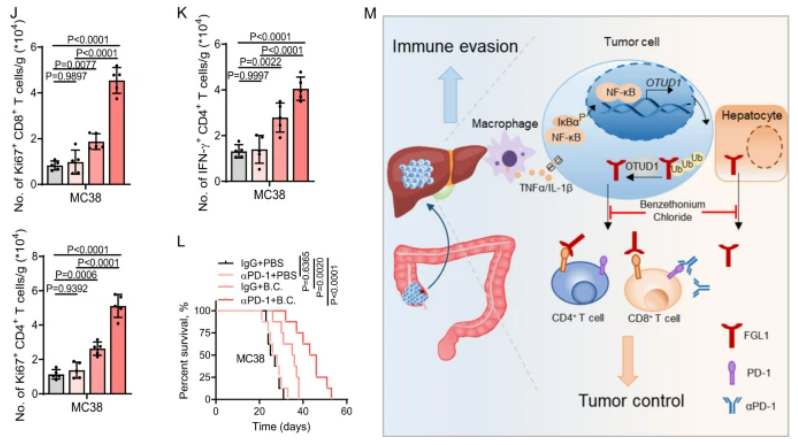
圖7:芐索氯銨通過減少FGL1的分泌來抑制肝臟微環境中的腫瘤細胞進展
A.圖中的z得分展示了1430種FDA批準藥物對HT29細胞中FGL1分泌的影響。B. 芐索氯銨是一種FDA批準藥物,其結構如圖示。C. 我們篩選了對FGL1水平有抑制作用的候選藥物,發現芐索氯銨顯著降低了HT29、B16F10和MC38細胞以及小鼠肝細胞中FGL1的分泌。D. 芐索氯銨處理減少了癌細胞中FGL1的蛋白表達。E. 在小鼠模型中,芐索氯銨處理顯著降低了肝轉移瘤的負擔,且不影響宿主體重和肝轉移瘤中TAMs的數量。F. 芐索氯銨處理降低了小鼠血漿中的FGL1水平。G. 芐索氯銨處理與抗PD-1療法協同作用,顯著抑制了肝重和減少了肝轉移灶的數量。這伴隨著腫瘤微環境中IFN-γ+ CD8+/CD4+和Ki67+ CD8+/CD4+ T細胞的增強。I-K. 組合治療顯著延長了小鼠的總體生存。M. 工作模型圖展示了肝臟微環境如何通過抑制FGL1分泌來促進抗腫瘤免疫反應。
小結
總的來說,該研究闡明了FGL1在促進轉移性癌癥進展中的關鍵作用和調控機制,強調了其預后價值和免疫治療的臨床意義。在小鼠模型中抑制FGL1,能夠與PD-1阻斷產生協同作用,這提示我們抗FGL1單抗和免疫檢查點阻斷(ICB)的聯合可能是肝轉移癌癥免疫治療的新策略。該研究豐富了我們對肝臟微環境中免疫細胞(腫瘤相關巨噬細胞、T細胞)和腫瘤細胞之間的機制聯系的理解,這些聯系有助于免疫逃逸和癌癥進展。
參考文獻
https://www.nature.com/articles/s41467-023-42332-0
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










