【客戶文獻解讀,IF>11】食管癌的"隱形推手":MALR-ILF3-HIF1a軸的強大作用
腫瘤相關巨噬細胞(TAM)是腫瘤微環境中數量最多的免疫細胞,對腫瘤的發生發展起到重要調節作用。作者發現了一種與巨噬細胞相關的長非編碼RNA(lncRNA),名為MALR,它可以促進食管鱗狀細胞癌(ESCC)的進展。TAM通過分泌TNFa上調ESCC細胞中MALR的表達,MALR可以通過激活HIF1a信號通路促進糖酵解和血管生成。在機制上,MALR與ILF3的dsRBD1結構域結合,促進ILF3蛋白的穩定性以及由ILF3介導的液-液相分離(LLPS),從而防止PARN介導的降解,提高HIF1a mRNA的穩定性。如果MALR缺失,基于細胞系的以及患者來源的異種移植腫瘤的生長會被抑制。在臨床上,MALR的高表達與HIF1a靶基因的表達正相關,并預示著食管癌患者的預后不良。總的來說,這項研究揭示了MALR/ILF3介導的LLPS在腫瘤微環境重塑中的生理作用,突出了MALR-ILF3-HIF1a軸作為癌癥治療的潛在靶點。
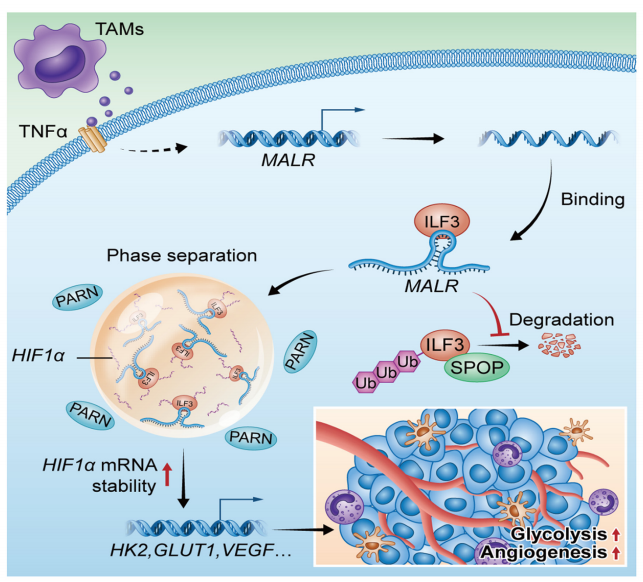
01 TAMs通過TNFa信號通路上調MALR的表達
作者首先從與TAMs共培養的ESCC細胞中分離RNA,并進行RNA-seq分析以確定TAM上調的lncRNA。通過比較與TAMs共培養的ESCC細胞和單獨培養的ESCC細胞,確定了前20個TAM上調的lncRNA(圖1A)。為了進一步縮小候選者范圍,作者對ESCC腫瘤組織與其配對的正常組織(N=20)進行了RNA-seq分析,并確定了前20個在腫瘤組織中上調的lncRNA(圖1B)。在上調的lncRNA中,只有一個候選者在兩組中均出現,這個lncRNA被命名為MALR。
通過qRT-PCR分析,證實了MALR在ESCC組織(圖1C)以及與來自患者的TAMs、M2型巨噬細胞或THP-1細胞共培養的ESCC細胞(KYSE150和TE-11)中上調(圖1D-F)。相關性分析顯示,ESCC腫瘤組織中MALR的表達與CD68的表達呈正相關,CD68被認為是巨噬細胞的一種特異性標記(圖1G)。此外,ESCC患者中MALR高表達者總體生存率和無病生存率較差(圖1H和I),這表明MALR是ESCC潛在的預后生物標志物。此外,當與TNFa敲低的TAMs共培養或用中和抗體阻斷TNFa時,腫瘤細胞中MALR的上調沒有發生顯著變化(圖1K;補充圖S1I),這表明TNFa是導致TAMs誘導MALR表達的主要炎癥細胞因子。綜上,這些結果表明TAMs通過TNFa信號通路上調MALR的表達。
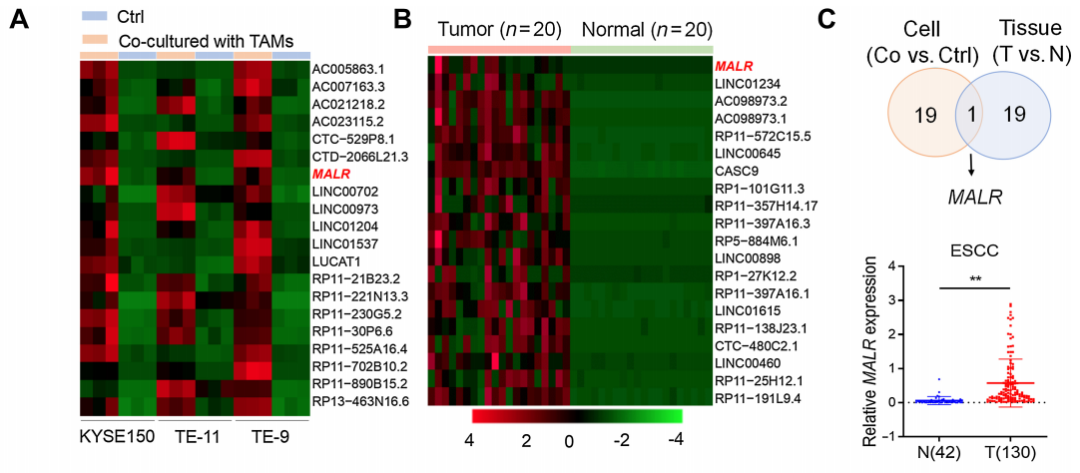
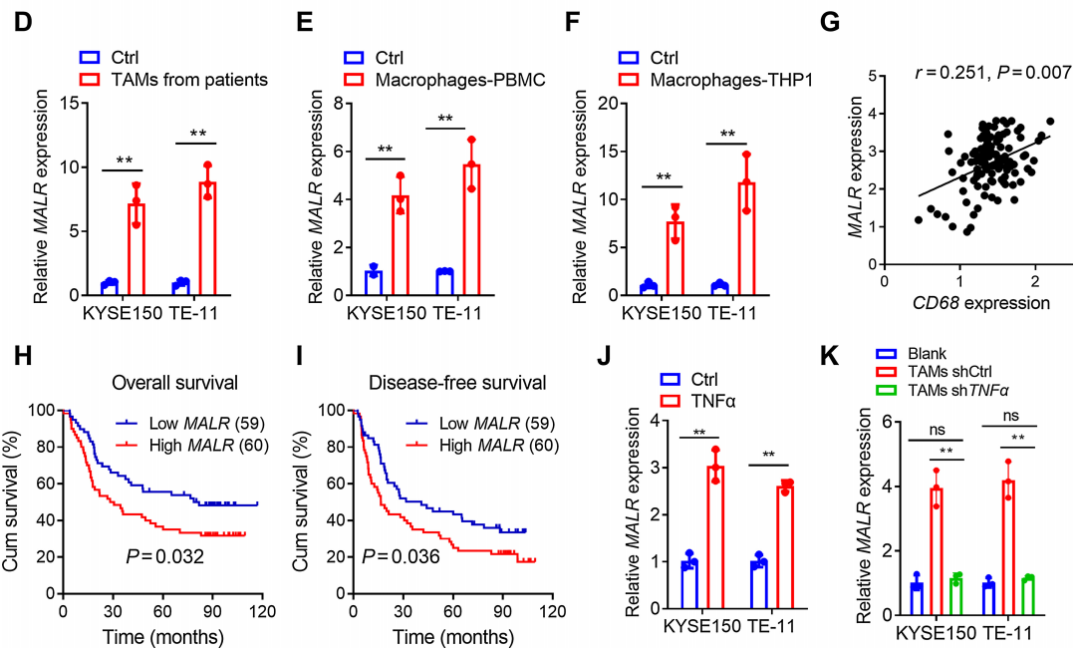
圖1. MALR通過TAMs分泌的TNFa上調
02 MALR通過激活HIF1a通路促進ESCC細胞的惡性表型
考慮到MALR可能參與ESCC的惡性發展,作者在兩個高表達MALR的細胞系中(TE-15和TE-9)構建了MALR敲除(KO)的ESCC細胞,并進行了RNA-seq分析以確定受MALR調節的靶基因。熱圖結果表明,在兩種ESCC細胞系中,當MALR敲除后HIF1a的表達顯著下調(圖2A)。據報道,HIF1a在缺氧條件下調控許多基因以刺激糖酵解代謝和血管生成。對TCGA數據的基因集富集分析表明,MALR高表達與缺氧、糖酵解和血管生成呈正相關(圖2B)。qRT-PCR分析顯示,在缺氧條件下培養的MALR敲除細胞中,HIF1a靶基因的轉錄顯著減少(圖2C),這一點也得到了免疫印跡(IB)分析的證實(圖2D)。這些數據表明MALR在癌細胞中可能激活HIF1a信號通路。
MALR的缺失顯著削弱了ESCC細胞在缺氧條件下培養時的糖酵解活性和細胞生長(圖2E和F;補充圖S2B)。VEGF是癌癥中關鍵的促血管生成因子,對癌癥進展至關重要。正如ELISA所證實的那樣,在缺氧條件下培養24小時后,MALR的缺失顯著降低了培養基中VEGF的分泌(圖2G)。此外,當人臍靜脈內皮細胞(HUVEC)在從MALR敲除細胞獲得的培養基中培養時,管狀形成能力顯著受損(圖2H)。TNFa刺激顯著增強了ESCC細胞在缺氧條件下培養時的糖酵解活性、細胞生長和管狀形成能力,而這種作用可被MALR敲除所減弱(圖2I-K)。綜上所述,這些數據表明MALR表達與HIF1a激活之間存在強相關性,并強調了MALR在重編程癌細胞代謝和促進血管生成中的潛在作用。
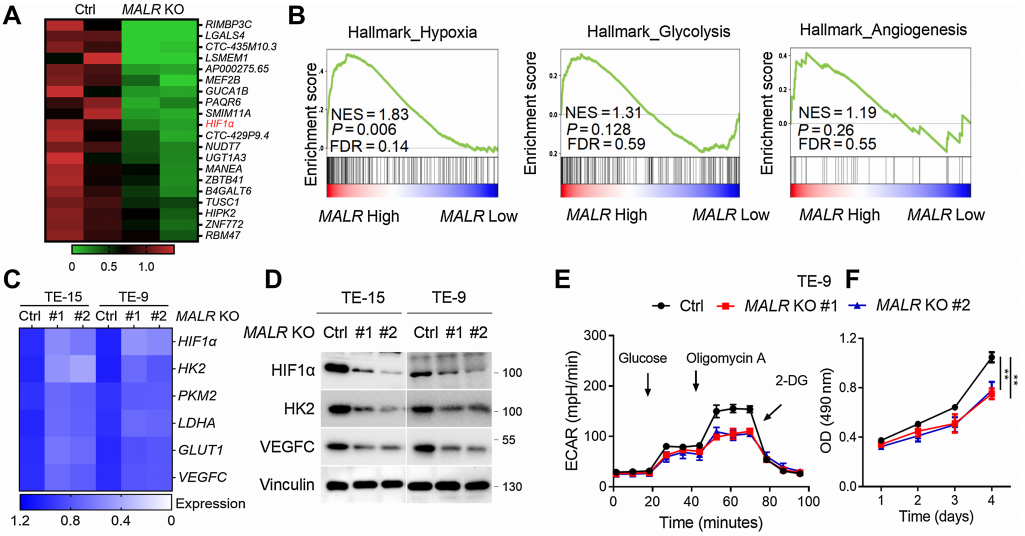
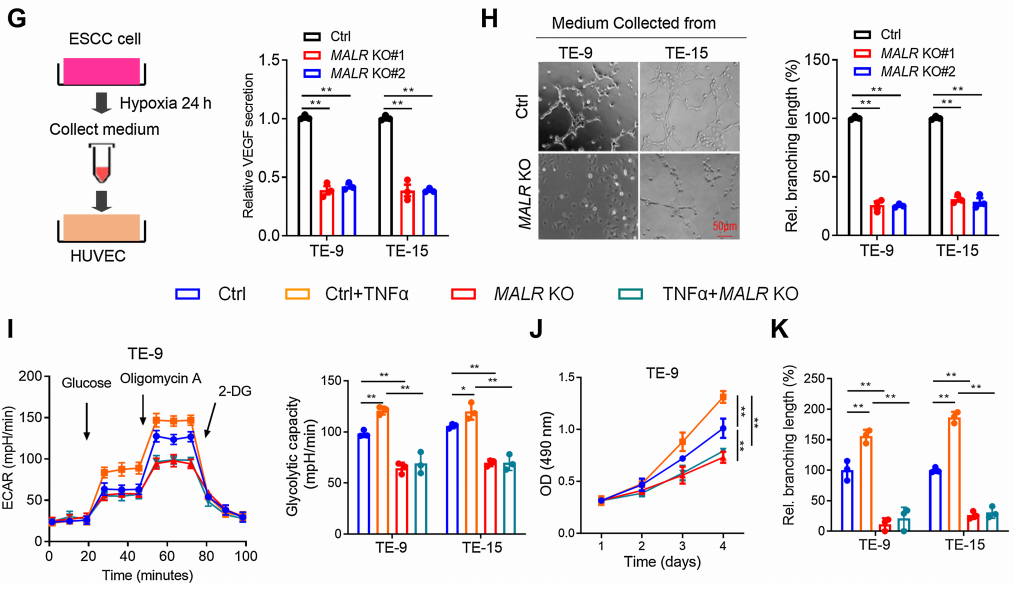
圖2. MALR通過激活HIF1a通路促進ESCC細胞的惡性表型
03 ILF3與MALR結合并經歷LLPS
接下來,作者通過FISH檢測和MALR的亞細胞定位發現MALR主要定位于細胞核(圖3A和B;補充圖S3A)。為了探究MALR在腫瘤進展中的潛在作用和機制,作者進行了RNA pull-down分析,隨后通過MS鑒定了與MALR相關的蛋白質,如之前報道的那樣,特異性與ILF3結合是正義MALR,而不是反義MALR(圖3C)。MALR與ILF3之間的特異性相互作用也通過RIP實驗得到證實(圖3D;補充圖S3B)。進一步的MTRAP實驗表明,與陰性對照相比,MS2-MALR和MCP-3FLAG質粒的共表達導致ILF3的明顯富集(圖3E)。作者還通過ChIRP分析在體內驗證了MALR與ILF3的相互作用(圖3F)。
此外,作者進行了CLIP-PCR分析,并鑒定了MALR的T3片段介導了MALR與ILF3的相互作用(圖3G)。通過進行ILF3蛋白序列的生物信息學分析,作者發現ILF3的C端高度無序,并包含IDRs(圖3H)。研究表明IDRs經常出現在相分離的隔室中,因此作者推測ILF3分子有可能發生LLPS。為了評估與MALR的相互作用是否誘導ILF3發生LLPS,作者將EGFP-ILF3蛋白(綠色)與Alexa Fluor 546-14-UTP標記的MALR(紅色)混合。混合后,ILF3和MALR形成了微米大小的液滴(圖3I),這在ESCC細胞中通過FISH和IF檢測也觀察到了(圖3J)。FRAP分析進一步證明了ILF3介導的LLPS的動力學特性(圖3K;補充影像S1)。如FRAP分析所示,液滴動態地改變,分子在液滴與周圍溶液之間進行交換(圖3K;補充影像S1)。綜上所述,這些結果表明ILF3蛋白能夠發生LLPS。
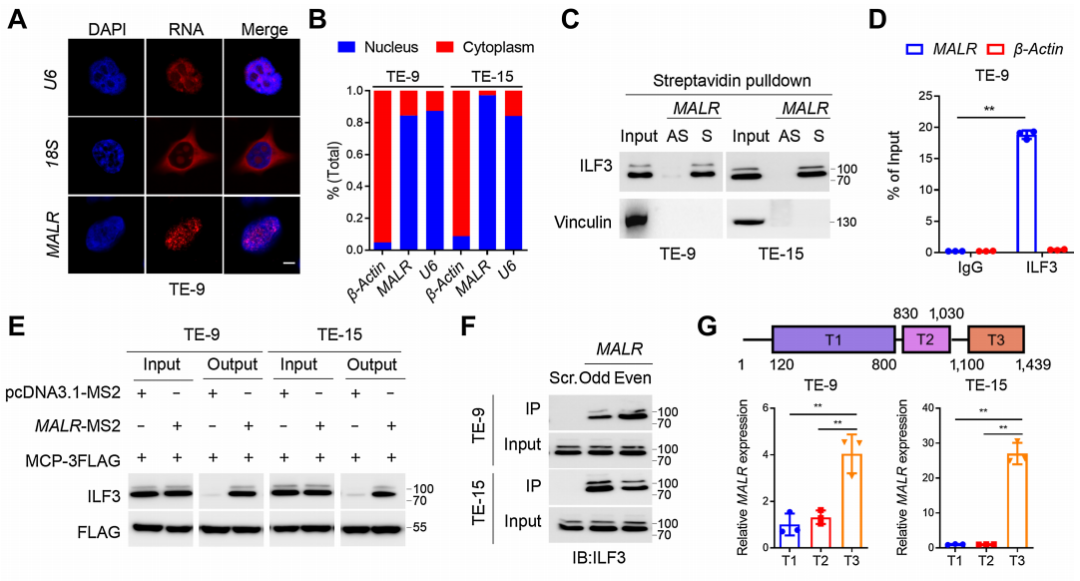
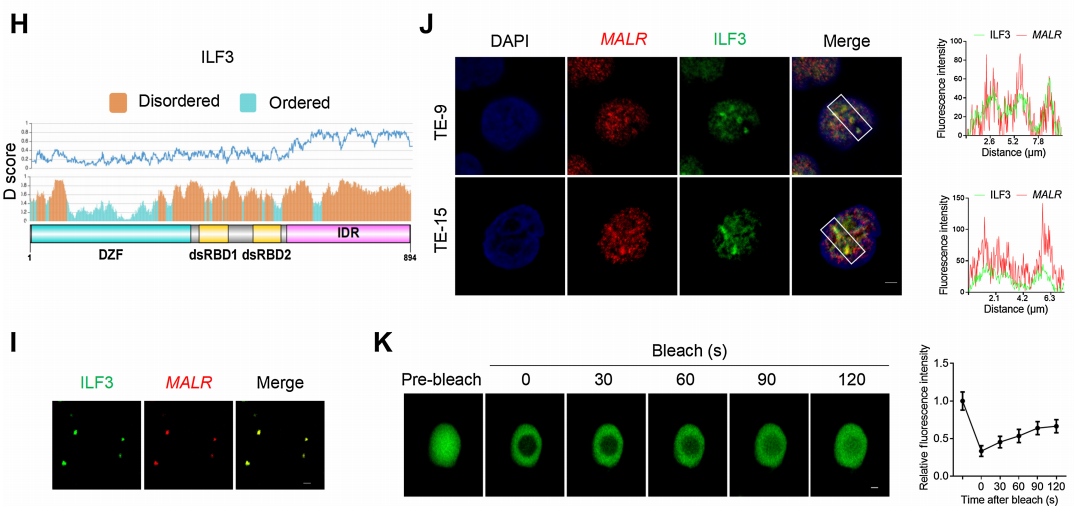
圖3. ILF3與MALR結合并經歷LLPS
04 MALR促進ILF3蛋白的穩定性和ILF3介導的LLPS
隨后,作者評估了MALR-ILF3相互作用對ILF3穩定性的功能效應。作者發現在ESCC細胞與巨噬細胞共培養或用TNFa處理后,ILF3的表達增加(圖4A;補充圖S4A)。具體來說,MALR KO ESCC細胞中ILF3的表達明顯減少,但通過蛋白酶體抑制劑MG-132處理可以恢復(圖4B),這表明MALR促進ILF3的穩定性。此外,敲除MALR對ESCC細胞中ILF3的穩定性有顯著影響,縮短了ESCC細胞中ILF3的半衰期(圖4C和D;補充圖S4B)。此外,作者在用FLAG標簽標記的ILF3表達的細胞中進行了IP試驗,用抗FLAG抗體進行IP檢測,并通過IB法檢測了泛素水平。結果顯示,MALR敲除顯著增加了泛素化ILF3的水平(圖4E)。這些數據表明,MALR是維持ILF3穩定所必需的。為了找出與MALR相互作用所需的ILF3蛋白的結構域,作者測試了幾種截短的ILF3蛋白形式并發現ILF3的dsRBD1片段在TE-9細胞中是必需的(圖4F)。綜上所述,ILF3的dsRBD1片段是MALR-ILF3相互作用和包括ILF3蛋白穩定性、細胞生長在內的關鍵功能所必需的。
之前的研究表明,SPOP是一種E3泛素連接酶,通過與dsRBD1片段附近的結構域的物理相互作用來調節ILF3蛋白的穩定性。基于這一發現,作者通過Co-IP實驗觀察到敲除MALR顯著增強了ILF3與SPOP之間的相互作用(圖4G),這一結果也得到了Duolink PLA實驗的證實(圖4H;補充圖S4H)。因此,作者的數據表明MALR通過阻止SPOP介導的泛素化來增加ILF3蛋白的穩定性。當ILF3-EGFP蛋白濃度為0.1mmol/L時,在不存在MALR的情況下觀察到了液滴的形成(圖4I)。此外,正交實驗表明ILF3的相分離依賴于MALR的劑量。在存在MALR的情況下,相同蛋白濃度下液滴形成能力顯著增強(圖4I)。為了進一步探討MALR對ILF3相分離的影響,作者在ESCC細胞中過表達MALR,發現顯著增加了ILF3點狀形成(圖4J)。MALR KO ESCC細胞中ILF3點狀形成受到抑制,這可以通過重新表達FL-MALR來挽救,而在DT3-MALR過表達組中則不是這樣(圖4K)。這些結果表明,MALR(尤其是T3片段)促進ILF3介導的LLPS形成并促進腫瘤生長。
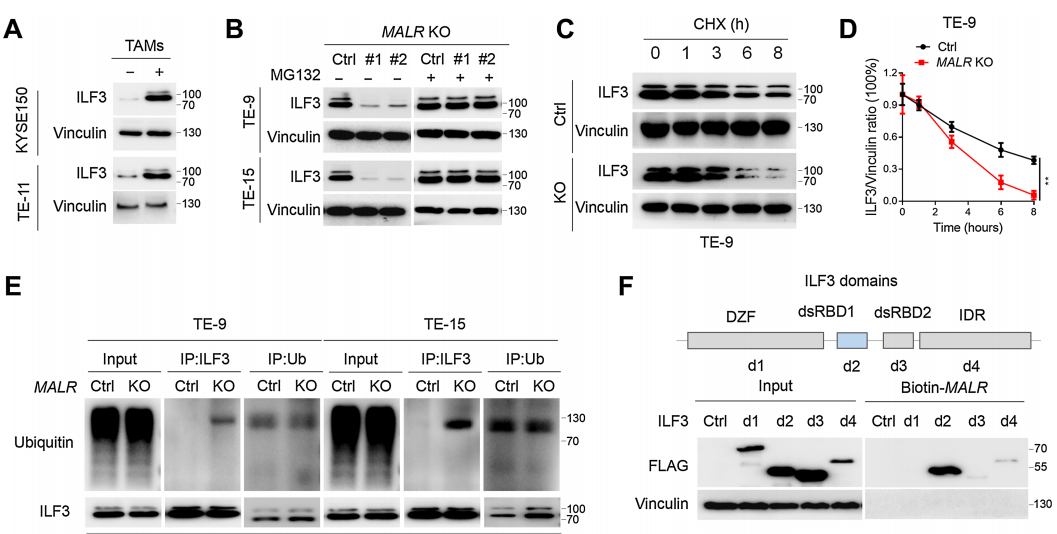
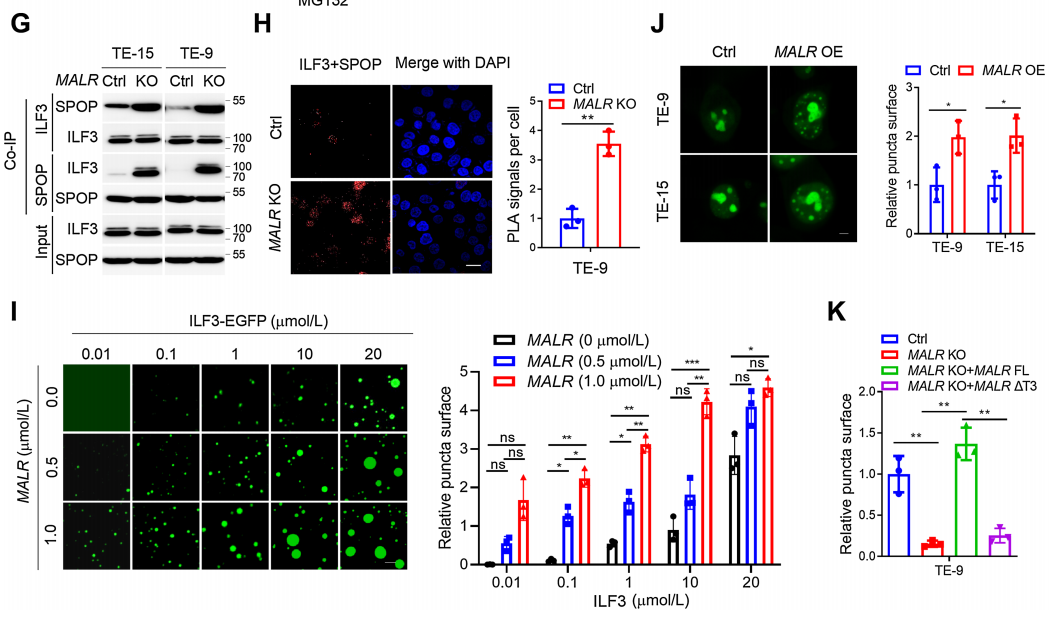
圖4. MALR促進ILF3蛋白的穩定性和ILF3介導的LLPS
05 MALR-ILF3介導的LLPS增加了HIF1a mRNA的穩定性
Actinomycin D是一種廣泛用于測量mRNA降解率的轉錄抑制劑,在ESCC細胞中,MALR的缺失降低了HIF1a mRNA的穩定性,而在這些細胞中加入Actinomycin D(圖5A;補充圖S5B)后也是如此。相反,TNFa處理顯著增強了HIF1a mRNA的穩定性,這可以通過在ESCC細胞中敲除MALR來挽救(圖5B;補充圖S5C)。此外,在MALR KO ESCC細胞中,HIF1a mRNA的穩定性降低可以通過外源性表達WT-ILF3來挽救,但不能通過DIDR-ILF3或DdsRBD1-ILF3來挽救(圖5C;補充圖S5D)。在MALR KO細胞中,HIF1a mRNA的穩定性降低不能通過與1,6-HD一起使用的WT-ILF3來挽救,卻可以通過與對照2,5-HD處理一起使用的WT-ILF3來挽救(圖5D;補充圖S5E和S5F)。綜上所述,這些數據表明MALR-ILF3介導的LLPS在促進HIF1a mRNA穩定性方面起著至關重要的作用。
如圖5E所示,作者推斷ILF3介導的LLPS可能阻止HIF1a mRNA與PARN之間的相互作用。敲除MALR顯著增加了HIF1a mRNA與PARN的相互作用,這通過RIP-PCR測定得到證實(圖5F)。作者進一步測試了ILF3 KO ESCC細胞中HIF1a mRNA與PARN的相互作用,RIP-PCR測定表明,敲除ILF3顯著增強了HIF1a mRNA與PARN的相互作用,這可以通過在ESCC細胞中過表達shRNA抗性的WT-ILF3來挽救,但不能通過過表達DIDR-ILF3或用1,6-HD處理來挽救(圖5G)。總的來說,這些數據表明,MALR-ILF3介導的LLPS通過防止PARN介導的識別和衰變來維持HIF1a mRNA的穩定性。
為了進一步研究MALR促進的ILF3相分離對腫瘤細胞惡性行為的影響,作者在MALR KO ESCC細胞中過表達了WT-ILF3或DIDR-ILF3(圖5H)。作者發現,在缺氧條件下培養的MALR敲除細胞中,WT-ILF3的過表達顯著挽救了HIF1a下游分子表達、ILF3點狀形成、糖酵解活性、細胞生長和管狀形成,但在DIDR-ILF3過表達組中則不是這樣(圖5H-L)。這些結果表明,MALR-ILF3介導的LLPS促進ESCC的體外惡性進展。
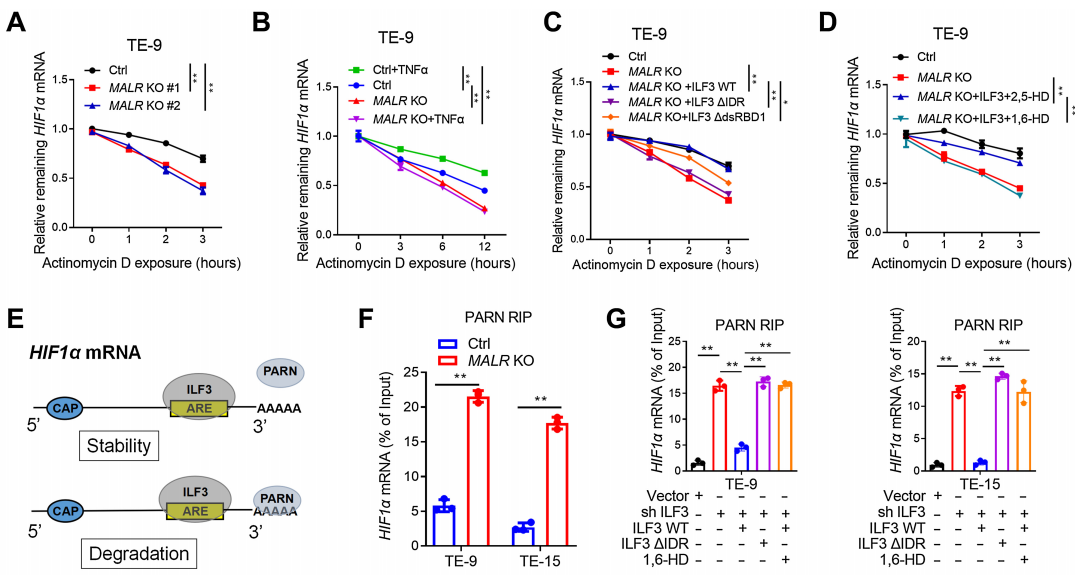
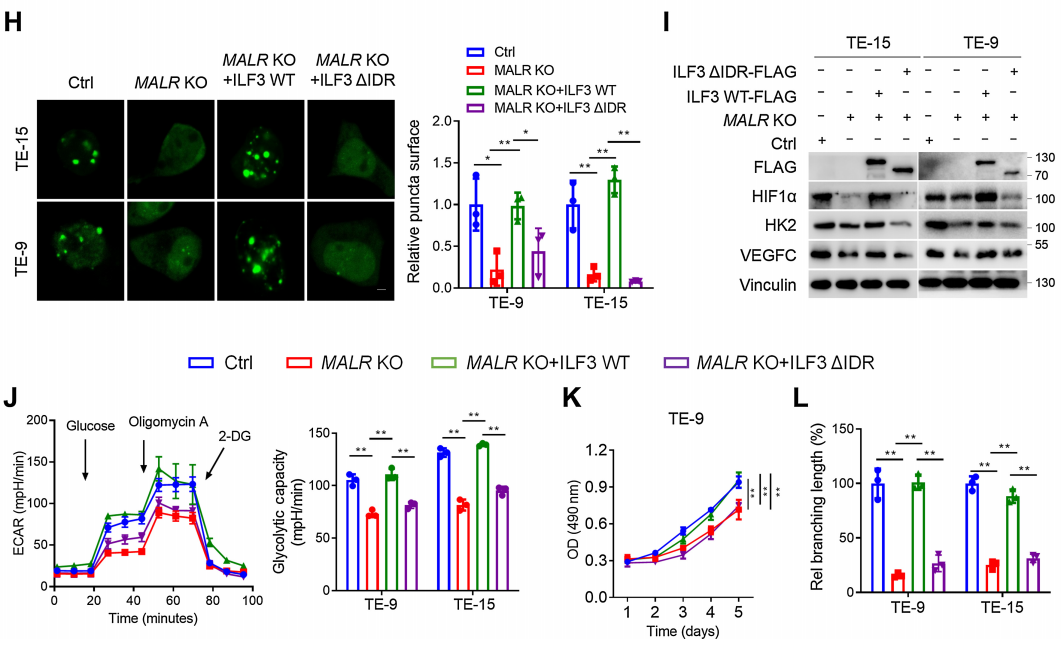
圖5. MALR-ilf3介導的LLPS維持了HIF1a mRNA的穩定性
06 MALR-ILF3介導的LLPS促進ESCC的惡性進展
接下來,作者研究了MALR-ILF3-HIF1a軸在體內腫瘤發生中的作用。如圖6所示,在ESCC細胞中下調MALR或ILF3顯著降低了基于細胞的異種移植腫瘤的生長(圖6A和B;補充圖S6A和S6B)。此外,Ki-67和CD31(內皮細胞標記)也表明,細胞增殖和血管生成也減少(圖6C;補充圖S6C)。作者通過IHC和IF染色檢測還證實,在異種移植腫瘤組織中,HIF1a表達和ILF3點狀形成在MALR或ILF3敲除后顯著減少(圖6C;補充圖S6C)。這些數據與作者在體外的發現一致。作者按照先前報道的方法將ESCC細胞和巨噬細胞注射到NSG小鼠中,增加了異種移植腫瘤的生長、增殖、血管生成和ILF3點狀形成,這可以通過在巨噬細胞中消耗TNFa以及在ESCC細胞中消耗MALR或ILF3來消除(圖6A-C;補充圖S6A-S6C)。值得注意的是,使用MALR抑制劑敲除MALR可顯著降低腫瘤生長、血管生成和ILF3點狀形成(圖6D-H;補充圖S6F)。綜上所述,這些結果表明MALR在ESCC發展中具有促腫瘤作用。
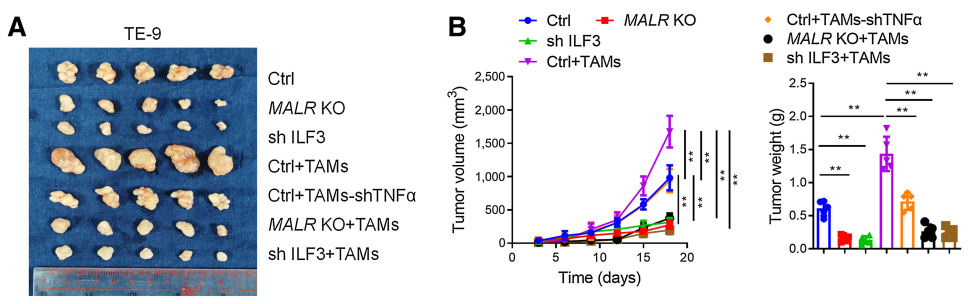
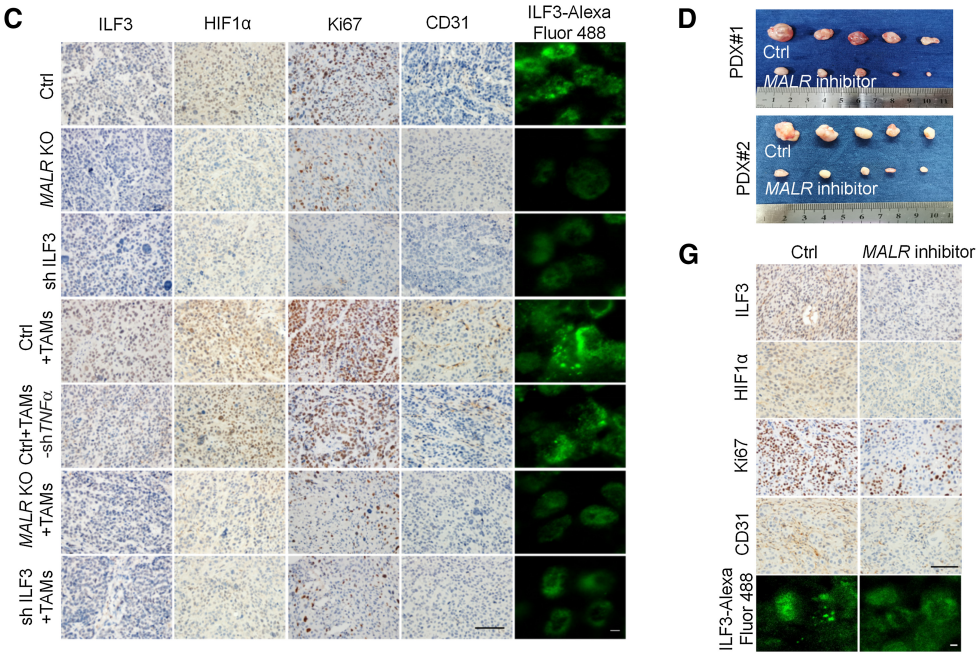
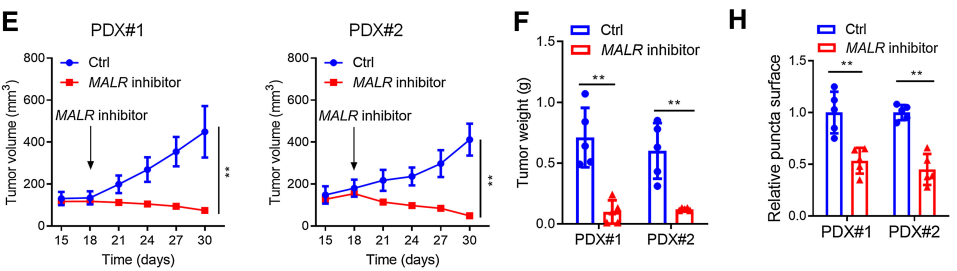
圖6. MALR-ilf3介導的LLPS促進體內腫瘤生長
07 ESCC患者中MALR-ILF3-HIF1a軸的臨床相關性
為了確定MALR及其上游或下游基因的表達與臨床的相關性,作者檢查了人類ESCC組織中的它們的表達譜。通過qRT-PCR檢測了MALR的表達,并根據中位數表達水平將樣本分為MALR-low和MALR-high組。作者進一步通過IHC分析在ESCC組織隊列中檢查了MALR與TAM標記物(CD68)、腫瘤細胞增殖標記物(Ki-67)和血管生成標記物(CD31)的表達水平之間的相關性(圖7A)。MALR-high組表現出較高的CD68、ILF3、HIF1a、Ki-67和CD31表達,而MALR-low組表現出相反的模式(圖7B)。值得注意的是,MALR的表達與ESCC組織中ILF3點狀的數量呈正相關(圖7C)。此外,MALR的表達與HIF1a及其下游基因在ESCC樣本中的表達呈正相關(圖7D和E)。總之,這些數據表明MALR-ILF3-HIF1a軸在人類癌癥的發展中起著重要的作用(圖7F)。
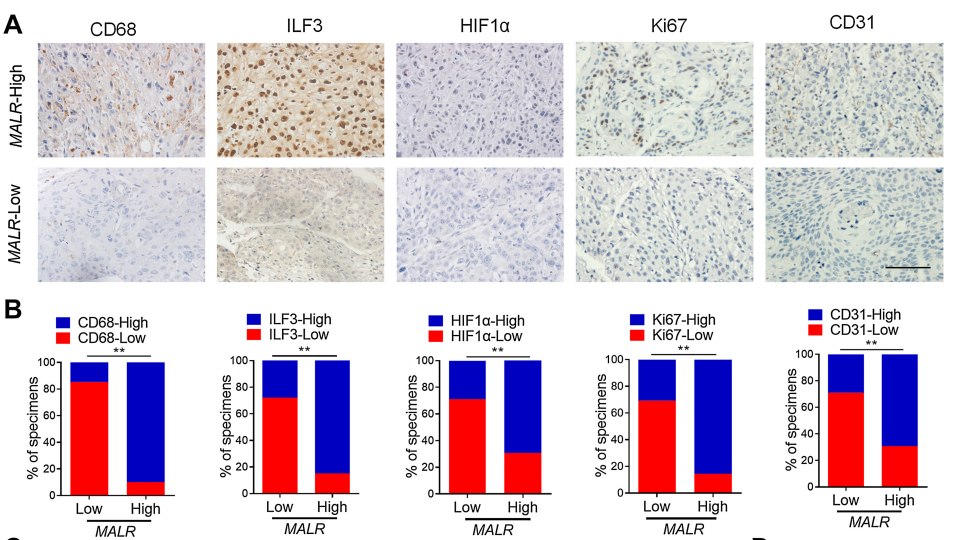
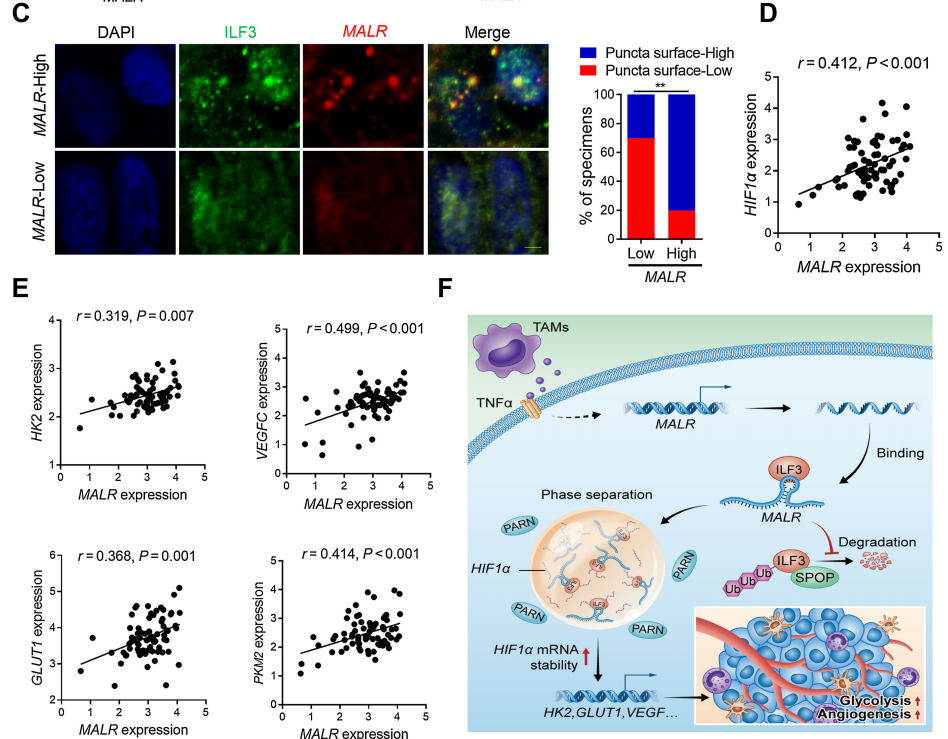
圖7. ESCC患者中MALR-ILF3-HIF1a軸的臨床相關性
小結
本研究發現lncRNA MALR在食管癌中發揮關鍵作用。TAMs通過分泌TNFa上調MALR,進而促進糖酵解和血管生成。MALR與ILF3結合增強HIF1a信號通路,促進腫瘤進展。在臨床樣本中,MALR的高表達與不良預后相關。因此,MALR-ILF3-HIF1a軸可能成為治療食管癌的潛在靶點。
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










