RNA提取經驗總結
信息來源:金開瑞 作者:genecreate 發布時間:2018-01-29 13:15:57
實驗前的準備
1、要了解你的實驗室環境,了解你的實驗環境中可能存在的隱患:是否有同事在進行DNA抽提?是否實驗室人員眾多?
2、要了解你可以使用的設備:離心機是否可以低溫操作?破碎、勻漿的條件怎樣?
3、要了解抽提RNA的目的。
4、要了解樣品的采集、制備、保存的條件,了解樣品的特點。
有了充分的了解后,才能正確選擇合適的方法/試劑,提高抽提的成功率。
RNA抽提“三大紀律八項注意”
紀律一:杜絕外源酶的污染。
注意一:嚴格戴好口罩,手套。
注意二:認真處理實驗所涉及到的試劑、耗材、環境。
紀律二:阻止內源酶的活性。
注意三:選擇合適的勻漿方法。
注意四:選擇合適的裂解液。
注意五:控制好樣品的起始量。
注意六:勻漿操作快速而徹底。
紀律三:明確自己的抽提目的。
注意七:任何裂解液系統在接近樣品最大起始量時,抽提成功率急劇下降。
注意八:RNA抽提成功的唯一經濟的標準是后續實驗的一次成功,而不是得率。
RNA抽提的10大竅門
1:快速阻止Rnase活性–樣品收集后快速冷凍,裂解時快速操作滅活Rnase。
2:選擇合適的抽提方法–高核酶含量的組織,脂肪組織最好用含苯酚的方法。
3:預判質量要求– Northern,cDNA文庫構建對完整性要求高,RT-PCR, RPA (Ribonuclease protection assay)對完整性要求不是很高。RT-PCR對純度(酶抑制物殘留)要求很高。
4:徹底勻漿是提高得率和降低降解的關鍵。
5:檢查 RNA的完整性–電泳檢測,28S:18S =2:1是完整的標志,1:1對大部分實驗也是可以接受的。
6:去除DNA –用于RT-PCR, array analysis最好用Dnase I去除DNA。
7:降低外源酶的污染–不能從外面又導入酶。
8:低濃度的核酸濃縮時,要加入助沉淀試劑。但要防止助沉淀劑含酶及DNA污染。
9:徹底溶解RNA,必要時可以65C加熱5分鐘。
10:合適的保存方法–短時間可以–20C保存,長期請保存于–80C。
提高RNA得率的方法
1:使用更有效的破碎/勻漿方法。RNA如果不能被有效釋放出來,得率是會降低的。液氮搗碎、酶消化破壁(Lysozyme/Lyticase)、電動勻漿器勻漿,雖然麻煩,但都是獲得高得率的有效手段。
2:抽提試劑的更換。假如得率低不是由勻漿方法不徹底引起,則可能是所使用的試劑的裂解能力差導致。最合理的做法是:使用更多的裂解液;用完后換廠家。另外,可以改用不使用苯酚/氯仿抽提的試劑/方法;使用苯酚/氯仿抽提的方法,由于不可能全部取出上清,RNA的損失是比較大的。
3:延長沉淀時間。如果核酸濃度低,采取低溫沉淀、并延長沉淀時間,可以獲得非常好的效果。
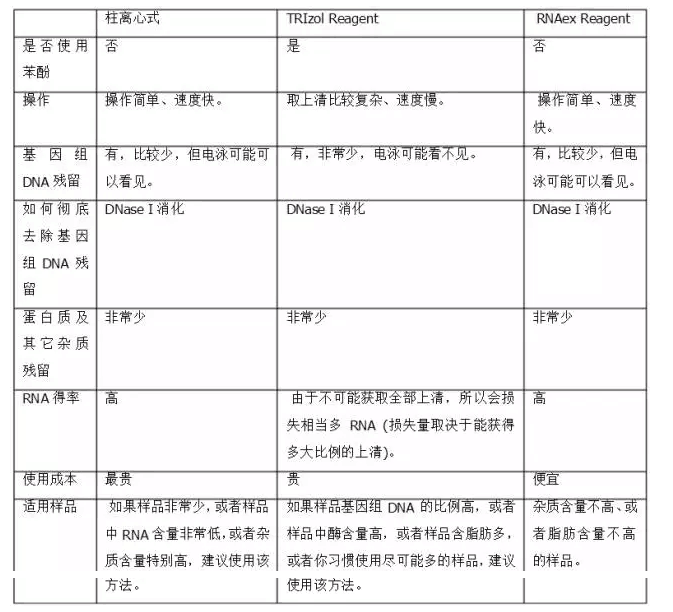
不同抽提總RNA方法的比較
詳見圖
上一條:細胞污染后的挽救方法
下一條:細胞侵襲及遷移實驗常見問題解答
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










