如何構建慢病毒穩轉株
信息來源:金開瑞 作者:genecreate 發布時間:2022-11-01 15:14:35
構建穩定細胞系的基本原理是將外源DNA克隆到具有某種抗性的載體上,載體被轉染到宿主細胞并整合到宿主染色體中,用載體中所含抗性基因進行篩選。最常用的真核表達載體抗性篩選標志物有新霉素(neomycin)、潮霉素(hygromycin)和嘌呤霉素(puromycin)。常用G418來代替新霉素進行選擇性篩選,篩選得到可穩定表達目的蛋白,或者穩定表達沉默特定基因的細胞株。
慢病毒感染方法篩選單克隆是目前主流的穩定細胞系篩選方法。慢病毒幾乎可以感染所有種類的細胞,并且在感染后可以整合到受感染細胞的基因組,進行長時間穩定表達。因此,慢病毒常用于制備穩定表達、沉默特定基因的單克隆細胞株。
特點及優勢
1. 長期在細胞中研究基因的功能(>2周);
2. 使用誘導表達系統,這主要是由于:a)過表達基因或者干擾目的基因引起細胞毒性或者抑制細胞生長等不利因素;b)目的基因的過表達或者干擾需要時空特異性。
3. 動物實驗,需將細胞注射到動物體內;
4. 構建工具細胞(生產、研究、篩選)。
| 慢病毒表達系統 | 特點 |
| 病毒類型 | RNA逆轉錄病毒 |
| 能否自主復制 | 否 |
| 能否自行擴增 | 需要特殊包裝系統和包裝環境 |
| 是否整合 | 是,病毒基因組整合于宿主基因組,長時間、穩定表達外源基因 |
| 克隆容量 | 可插入不超過8kb的外源片段,滴度隨插入片段長度增加而降低 |
| 感染細胞類型 | 感染絕大多數細胞,包括分裂期、非分裂期細胞 |
| 表達時間 | 慢(2-4 天) |
| 表達豐度 | 中等水平 |
| 滴度 | 可達108-1010TU/mL |
| 免疫原性 | 低免疫原性 |
| 基因過表達 | 包裝容量有限,過表達的基因過大時,病毒滴度受到影響 |
| microRNA過表達 | 適合,是過表達microRNA實驗的首選工具 |
| RNAi | 適合,是RNAi實驗的首選工具 |
| 下調microRNA | 有報道 |
流程及注意事項
1. 慢病毒載體構建,過表達載體或者干擾載體構建
慢病毒過表達載體有基因容量限制,對于大于5k的基因,包裝出慢病毒的概率很低,不建議包裝病毒。同時大于3k的目的基因也可能有不出毒或者出毒量低,在做正式實驗之前,可用先進行病毒的小量包裝,成功后再進行病毒大量包裝。對于敲低,通常的策略是對一個基因同時選擇3個干擾靶點,通過qPCR驗證干擾效率之后,使用效率最好的靶點進行下一步實驗。
慢病毒載體帶有不同的標簽,如果研究細胞定位,可以選擇帶熒光標簽的慢病毒載體,比如帶GFP/RFP等;如果準備篩選穩轉細胞株,可以選擇帶篩選標簽的慢病毒載體,比如puro/neo等載體;如果目的基因大小適中,也可以選擇同時帶熒光標簽和篩選標簽的載體。
2. 293T細胞培養及慢病毒包裝
細胞的狀態對于病毒包裝有很大的影響,如果細胞狀態不好可能不出毒或者出毒量很低。取狀態良好,處于對數生長期的293T細胞進行慢病毒包裝。第三代四質粒包裝質粒配比,可以按照分子量來折算,并在附近量做實驗,摸索最適質粒配比,以得到更高滴度的病毒。
3. 慢病毒滴度檢測及保存,使用熒光梯度稀釋法或者qPCR法檢測
慢病毒表達時間較慢,熒光表達所需時間較長,建議感染后72小時后觀測熒光表達或者qPCR檢測。感染期間請根據細胞生長的情況對細胞進行及時換液,以保證細胞良好的生長狀態。值得考慮的是使用低濃度的血清來培養細胞,作用是抑制細胞增殖。
特別注意,慢病毒可以存放于-80℃6個月以上,但如果病毒儲存時間超過6個月,建議在使用前重新滴定病毒滴度。反復凍融會降低病毒滴度,每次凍融會降低病毒滴度10%,因此,在病毒使用過程中應盡量避免反復凍融,強烈建議收到病毒后按照每次的使用量將病毒進行分裝。
4. 目的細胞MOI值摸索,確定最適慢病毒感染復數
同一種細胞在不同實驗室中由于傳代次數、操作細節的不同,細胞狀態會有所差異,另一方面病毒液在運輸、保存過程中可能造成即時滴度的變化。因此為了達到最佳的實驗效果,建議在正式實驗前進行3-4種不同MOI的感染預實驗。細胞匯合度對抗生素篩選結果的影響很大,一般篩選時細胞匯合度不宜超過50%。
5. 目的細胞藥物篩選濃度確定-通過梯度實驗
使用不同濃度的抗生素對細胞進行處理,選擇出在10-14天內使細胞全部死亡的最低抗生素濃度來進行下一步的篩選試驗。不同的細胞對于同一種抗生素,其篩選濃度不同,而同一種細胞對于不同的抗生素,其最佳使用濃度也不同。所以在進行穩轉株篩選之前,一定要先進行藥物濃度篩選預實驗以確定最佳藥物篩選濃度。
6. 慢病毒感染目的細胞及多/單克隆穩轉株篩選
由于基因轉染到細胞內之后要一段時間才能表達出蛋白質,所以篩選不能太早,但是也不能太晚,因為轉染了外源基因的細胞代謝負荷較大,增值較慢,時間長了就會被沒有外源基因轉入的細胞所淹沒,最終導致篩選不出陽性克隆。一般在轉染24小時之后才開始加抗生素記性篩選。加藥篩選后,死亡的細胞會裂解釋放出有害物質,導致那些有抗生素表達的陽性細胞死亡,即非選擇性死亡,因此要及時換液。
7. 慢病毒穩轉株檢測,通過qPCR或者Western Blot檢測目的基因
需要注意的是,mRNA的表達水平可能和蛋白的表達水平不一致,如果需要進一步研究蛋白的功能,可以使用WB檢測蛋白的表達水平。
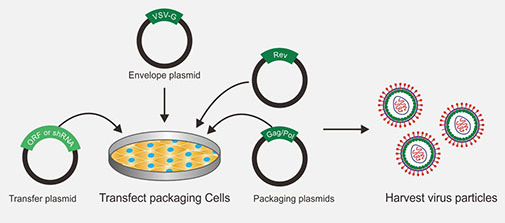
慢病毒包裝流程
案例展示
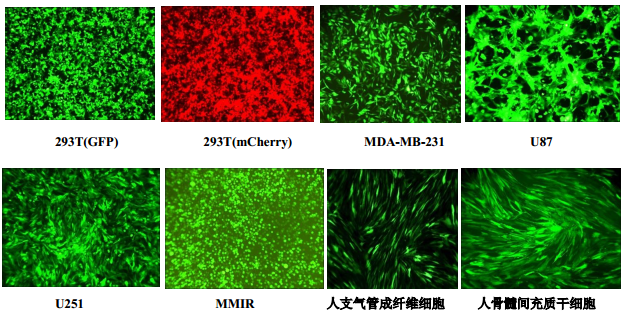
1 慢病毒穩轉株熒光檢測
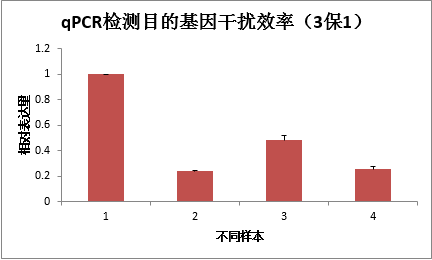
2 干擾慢病毒穩轉株qPCR檢測(3保1)
3 過表達慢病毒穩轉株Western Blot檢測(4株不同細胞)

相關技術服務
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










