蛋白質組和轉錄組聯合研究果蠅生命發育周期
信息來源:金開瑞 作者:genecreate 發布時間:2018-09-26 16:41:59
題目:The developmental proteome of Drosophila melanogaster
黑腹果蠅發育蛋白質組學研究
期刊:Genome Research
影響因子:10.101
主要技術:Label free,轉錄組
研究背景
果蠅(Drosophila melanogaster)是用于研究發育和衰老的最佳模式生物。在其生命周期中,它的發育階段包括胚胎、幼蟲、蛹和成體,經歷了完整的表型變態。目前雖然已經在RNA水平上對果蠅進行了深入研究,但仍然缺少涵蓋整個生命周期的全面蛋白質組學研究。
研究內容及結果
1. 果蠅整個生命發育周期的蛋白質組學分析
作者選擇了果蠅整個生命發育周期(胚胎、幼蟲、蛹、成蟲)中15個代表性時間節點的全動物樣本進行label free蛋白質組學分析(圖1A),每個時間節點進行4次生物學重復,每個重復樣本進行5h深度質譜上機檢測。因在果蠅幼蟲階段的食物中包含酵母蛋白,作者在質譜下機數據搜庫分析中分別選用了釀酒酵母和果蠅的數據庫。在本次實驗中,作者共鑒定到9627個蛋白質,其中1078個酵母蛋白質(幾乎完全局限于幼蟲階段)和8549個果蠅蛋白質(圖2A)。隨后作者選擇了至少有兩次重復鑒定到的蛋白(7952個)進行層次聚類分析和PCA分析,發現在同一時間點內重復樣品具有非常高的相關性(R = 0.84-0.98),而且PCA分析有很清晰的蛋白聚類,表明作者的實驗條件從生物系統到質譜測量具有非常高的重現性(圖1,圖2)。

圖1 果蠅發育生命周期蛋白質組學分析
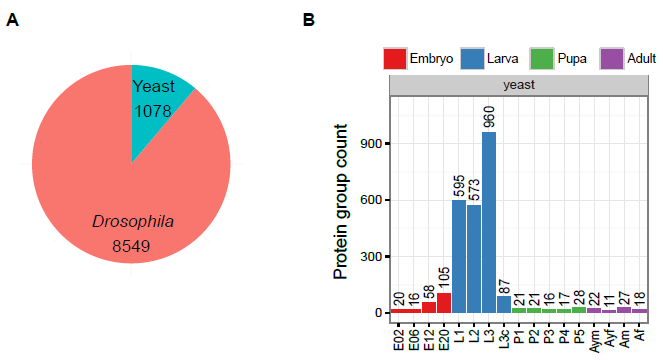
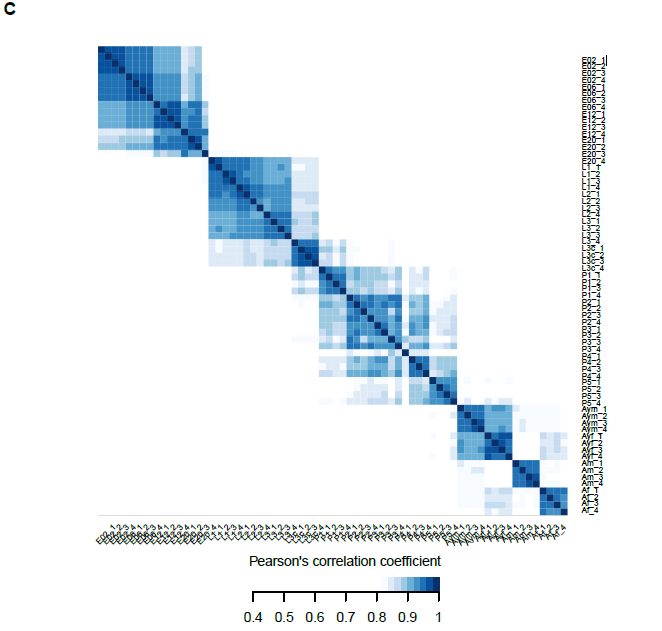
圖2 label free蛋白鑒定及相關性分析
2. 核心蛋白質組及蛋白表達動態變化
作者發現,有4627個蛋白質存在果蠅整個生命發育周期中(圖3A)。隨后,對這些連續表達的蛋白進行GO注釋富集分析,研究它們主要參與的功能(圖3B),結果顯示這些核心蛋白富含代謝和細胞過程中的基本活動。作者又分析了所有蛋白質的發育表達動力學,有1386個蛋白在果蠅的整個生命周期中穩定表達,如微管蛋白、肌動蛋白、熱休克蛋白等。
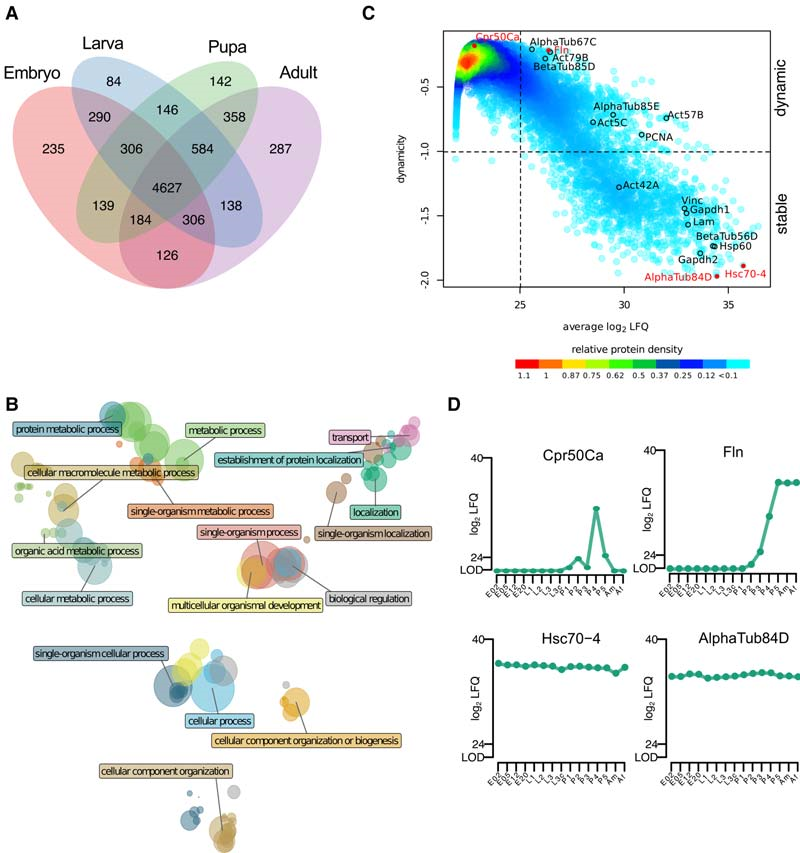
圖3 果蠅發育蛋白質組表征
3. 發育進程中差異蛋白分析
為了研究不同發育階段表達特異性蛋白,作者進行了ANOVA分析(FDR <0.01),發現有1535個差異表達蛋白。GO富集分析結果顯示,與有絲分裂調控、細胞周期、發育所需的激酶系統相關的蛋白得到顯著富集(圖4A)。基于上述結果,作者分離了早期和晚期胚胎發生階段:早期階段(0-6小時)的特征在于參與細胞骨架組織、微管結合蛋白的蛋白質的高表達;晚期階段(12-20h)的特征在于參與組織形態發生的蛋白質高表達(圖4B)。在幼蟲和蛹階段,角質層蛋白和表皮蛋白等出現高表達,成蟲階段則是氣味結合蛋白(Obp83b、Obp57a)、參與肌肉收縮的蛋白質(flightin(Fln)、Eaat1)、涉及光感和光轉導的蛋白質(Arr1和Arr2)和視網膜變性蛋白A(RdgA)高度表達(圖4B)。總體而言,作者將蛋白質表達與果蠅發育過程中形態學變化有效聯系起來。
結合轉錄組數據,作者發現蛻皮激素誘導的基因家族71E(Eig71E)在蛹階段中mRNA表達水平和蛋白質的表達譜之間存在有趣的差異:Eig71E家族的mRNA表達在早期蛹階段三個時間節點可以檢測到(L3c節點的Eig71Ee,P1節點的Eig71Ed,P2節點的Eig71Ek),但相應的Eig71E蛋白顯示延長高表達水平直至P5節點(圖4C,D)。而大多數情況下,在單個時間點檢測蛋白質,其RNA在多個時間點可檢測到(圖 3E)。綜上所述,轉錄組學可能不能直接預測蛋白質水平,這表明蛋白質組數據用于研究果蠅發育的必要性。
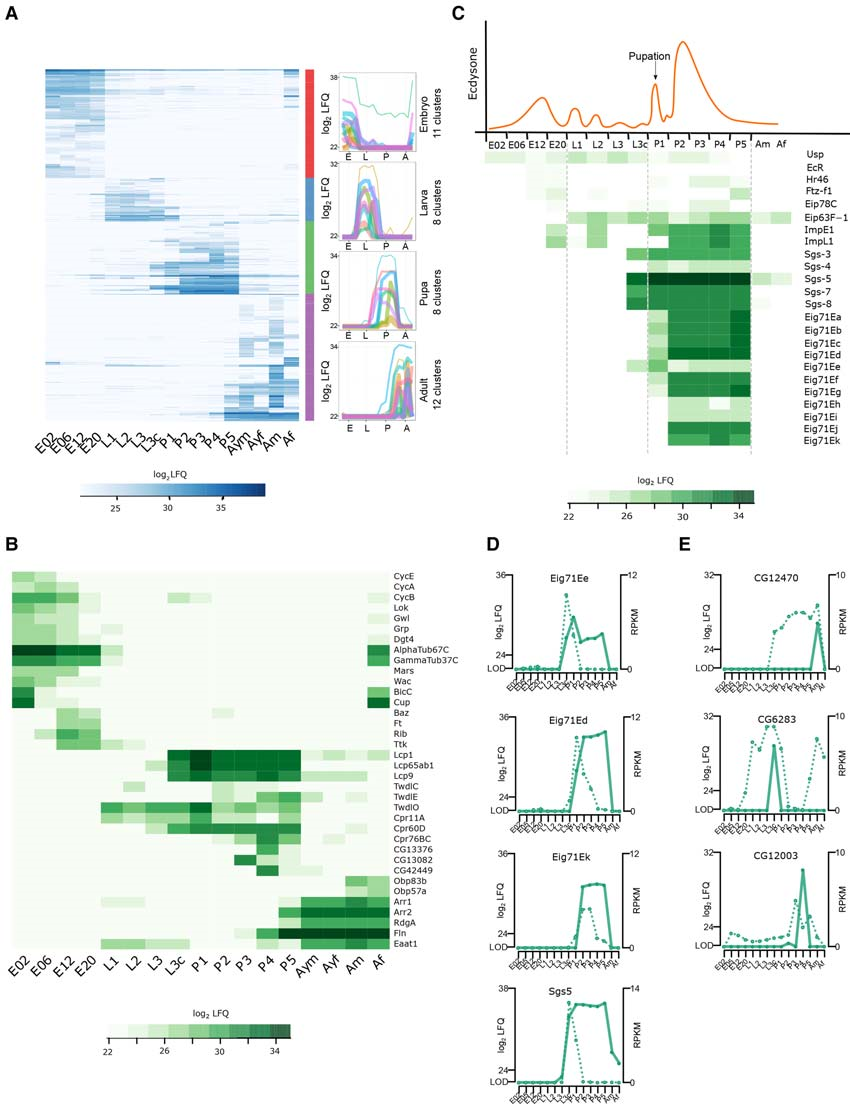
圖4 不同發育階段相關蛋白分析
4. 成年果蠅性別特異性蛋白模式的比較
性別特異性蛋白質一直是研究的重點,因此,作者將果蠅成蟲時間節點的蛋白質組學數據與已有的SILAC數據集進行了比較,發現性別特異性蛋白質高度重疊(R = 0.84),表明作者的發育蛋白質組囊括了以前的研究。此外,作者發現308個雄性和374個雌性相關特異性蛋白質(圖5A)。雄性特異性蛋白包括精子特異性鞭毛蛋白(Tektin-A、Tektin-C)和雄性發育中起作用的蛋白質(Lectin-46Ca、Lectin-46Cb、Lectin-30A)等,雌性特異性蛋白中包括卵黃膜(Vm32E)、絨毛蛋白(Cp15,Cp18、Cp36)、卵黃蛋白原(Yp1、Yp2、Yp3)和脂肪酸去飽和酶Fad2等。

圖5 性別特異性蛋白質組分析
5. 比較轉錄組和蛋白質組以研究轉化延遲
作者將胚胎發育蛋白質組與轉錄組進行了聯合分析比較,結果表明,胚胎發生過程中一般蛋白質復雜性增加(圖6A),轉錄組與蛋白質組只有中等相關性(最大R = 0.5),并且最佳相關性是非同步的,蛋白組延遲約4-5h(圖6B)。通過多維縮放然后聚類分析,作者將mRNA /蛋白質表達譜分組成六個簇(圖 6C)。在大多數情況下,mRNA表達在早期時間點更豐富,而蛋白質表達在后期達到峰值。除了簇1之外,剩余的簇說明了胚胎發生過程中mRNA和蛋白質的不同行為。在第5和第6簇中觀察到時間蛋白質組延遲:當RNA表達在約7小時達到峰值時,蛋白質在胚胎發生后期穩定上調,這可能是由于翻譯控制機制。
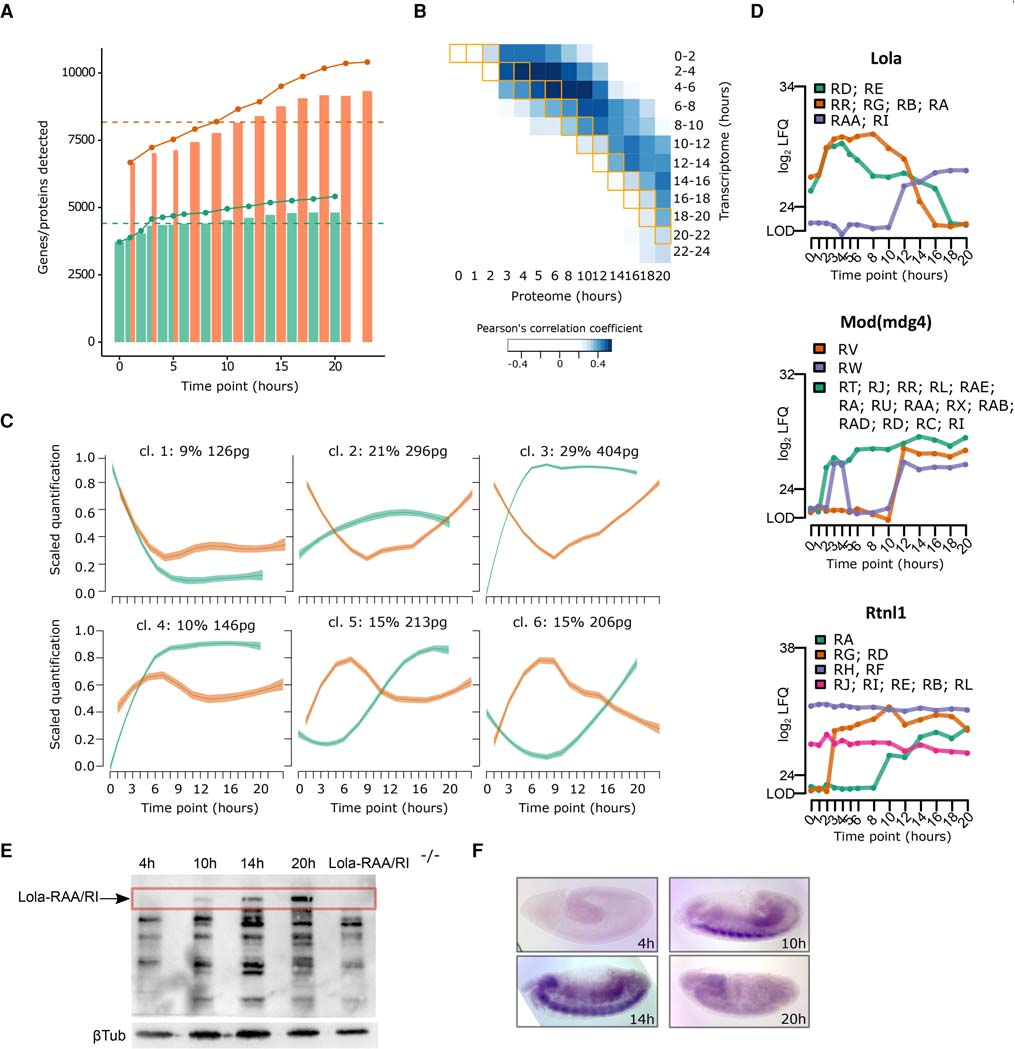
圖6 轉錄組和蛋白質組聯合分析
文章小結
作者完成了果蠅的胚胎發育和整個生命周期高質量的蛋白質組數據集,縮小了蛋白質表達系統發育研究的空白。此外,與可用的轉錄組數據的比較,揭示了mRNA和蛋白質之間差異相關性,強調了蛋白質組學在研究發育中的重要性。胚胎發生蛋白質組與組織特異性數據的整合揭示胚胎發育的時空特異性,可用于進一步研究功能尚未表征的蛋白質。
解析文獻
Casas-Vila N, Bluhm A, et al. The developmental proteome of Drosophila melanogaster. Genome Research, 2017 , 27 (7) :1273
參考文獻
1. Butter F, Bucerius F, et al. Comparative proteomics of two life cycle stages of stable isotope-labeled Trypanosoma brucei reveals novel components of the parasite’s host adaptation machinery. Mol Cell Proteomics. 2013, 12: 172–179.
2. Cox J, Hein MY, et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Mol Cell Proteomics.2014, 13: 2513–2526.
3. Dejung M, Subota I, et al. Quantitative proteomics uncovers novel factors involved in developmental differentiation of Trypanosoma brucei. PLoS Pathog. 2016, 12: e1005439.
4. Fabre B, Korona D, et al. Analysis of Drosophila melanogaster proteome dynamics during embryonic development by a combination of labelfree proteomics approaches. Proteomics. 2016, 16: 2068–2080.
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










