定量蛋白質組學研究神經元分化過程蛋白表達變化
信息來源:金開瑞 作者:genecreate 發布時間:2018-12-11 15:43:00
題目:Quantitative Map of Proteome Dynamics during Neuronal Differentiation
定量蛋白質組學研究神經元分化過程蛋白表達變化
期刊:Cell Reports
影響因子:8.032
研究背景
神經元分化是一個多步驟過程,一般經過幾個階段,包括軸突生長、樹突發生和突觸形成、塑造和重塑神經元。但是對神經元分化過程中系統生物學動態變化研究多集中在轉錄組水平,基因在轉錄水平的變化不一定能代表最終功能執行者蛋白質的變化。因此,有必要系統的研究神經分化過程中蛋白質的動態變化。
研究內容及結果
1. 大鼠海馬神經元蛋白表達譜
為了分析分化過程中神經元蛋白質組的改變,作者將大鼠原代海馬神經元在無血清的神經基質培養基中培養生長,并收獲軸突形成期DIV1、樹突生長期DIV5、突觸發生和成熟期DIV14細胞,使用蛋白質組學技術對不同時期的細胞進行質譜檢測定量分析(圖1A)。總共鑒定到了6753個蛋白,其中4354個蛋白有定量信息,有1793個蛋白質發生超過2倍的表達量變化(|log2(FC)| > 1),表明在神經元分化過程中至少有1/3的神經元蛋白發生重構(圖2B)。以Rattus norvegicus蛋白質數據庫作為背景的富集分析結果顯示,本次組學數據已涵蓋了大鼠海馬神經元大部分特異性蛋白(圖1B),平均相對蛋白豐度跨越5個數量級(圖1C),位于軸突和神經末梢的蛋白質是除常見的核小體蛋白質和蛋白酶體之外豐度最高的蛋白質。Pearson相關性分析表明本次實驗生物學重復之間的相關性良好(圖1D,圖2A)。
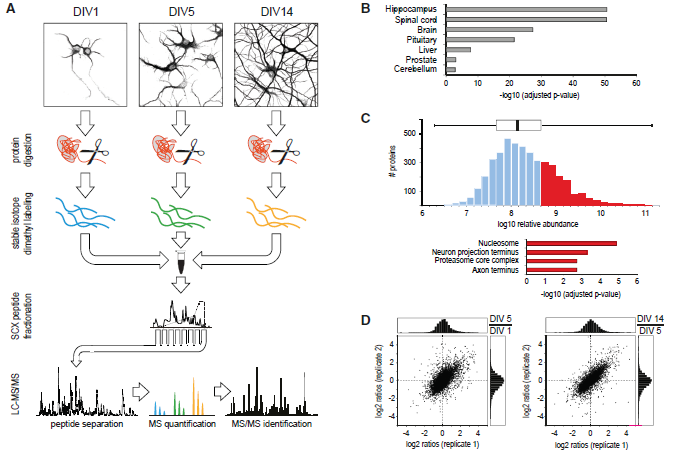
圖1 海馬神經元發育分化定量蛋白質組學分析
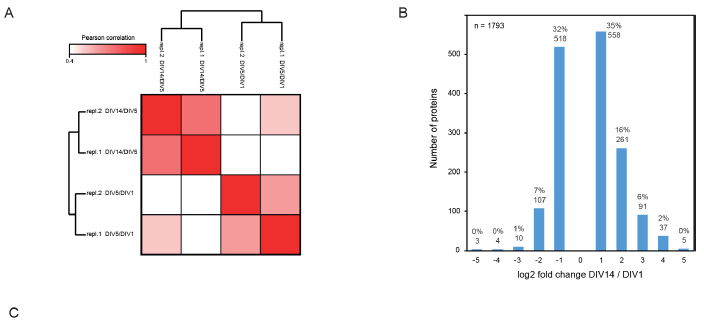

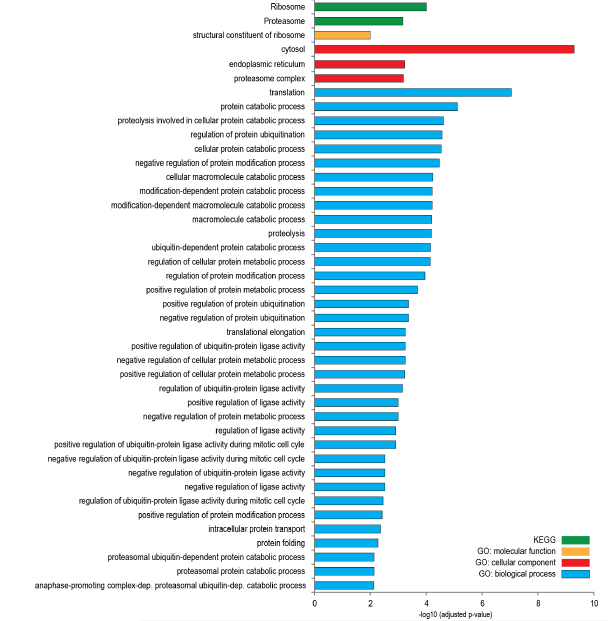
圖2 生物學重復性分析和差異蛋白分析
2. 神經元分化過程中蛋白質組動態變化
作者對定量到的4354個蛋白質在不同發育階段表達量進行深入分析,表達量沒有發生明顯改變的蛋白質多參與生物過程,如翻譯、蛋白分解代謝、蛋白酶體等(圖2C),這說明在神經元分化期間蛋白質組重塑過程中全局蛋白質周轉率基本上不受影響。
為了獲得神經元分化過程中蛋白質組表達動態變化,作者對所有表達量顯著變化的蛋白質進行表達模式聚類分析,發現有6種表達模式(圖3A)。其中蛋白質在Cluster 1、2和3中的分化期間上調,在Cluster 4、5和6中的分化期間下調。此外,功能注釋分析顯示特定Cluster內許多蛋白在細胞成分、分子功能以及生物過程方面具有共同的特性(圖3B)。Cluster6含有從DIV1到DIV5顯著下調的蛋白質,參與早期神經元分化期間精確定時的下調,以細胞周期調控和DNA復制等多種蛋白為主(圖3C),Cluster5中的蛋白隨時間持續下調,富含與染色質相關的蛋白質,Cluster4中的蛋白質表現出從DIV5到DIV14的顯著下調,該Cluster中的許多蛋白質與RNA代謝相關,Cluster3中的蛋白從DIV1到DIV5顯著上調,其中許多蛋白質與細胞粘附和細胞信號相關,Cluster2中的蛋白從DIV1到DIV14一直在顯著上調,主要是與陽離子傳輸和神經遞質分泌有關的蛋白質,Cluster1中的蛋白從DIV5到DIV14顯著上調,其中包含了參與多糖、氨基酸和脂類代謝在內的多種代謝過程的蛋白質。
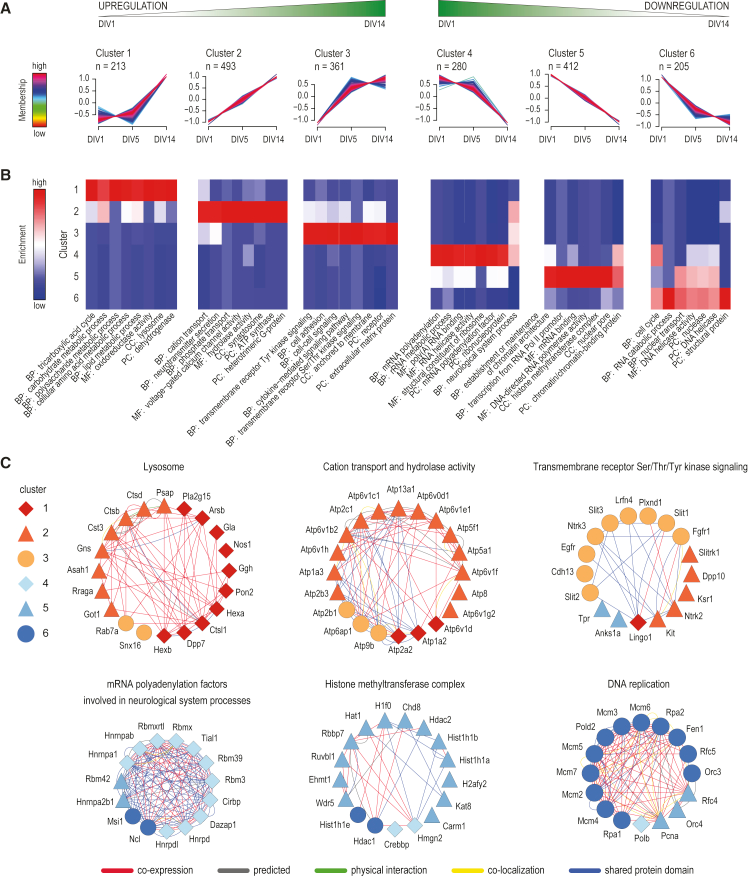
圖3 神經元分化過程中動態蛋白質組重塑
3. 神經元發育過程中的突觸和細胞粘附蛋白質分析
作者隨后研究突觸發生過程中蛋白表達動態變化,這是神經元發育中的一個關鍵事件,需要協調組裝高度連接的蛋白質網絡,包括支架蛋白、受體及其下游靶標、信號分子和細胞粘附蛋白。培養期間海馬神經元發育期間的突觸形成發生在DIV5至第DIV14階段,大多數差異表達的突觸蛋白被分配到Cluster2,這表明從DIV1到DIV14的相對蛋白質水平穩定增加,這些蛋白多為參與囊泡運輸(Syp、Syt1)、細胞骨架組織和蛋白質錨定(Cask、Pclo、Bsn)、神經遞質釋放(Syn1、Vamp2、Snap25、Sv2a、Sv2b)的重要突觸前蛋白(圖4C)。為了驗證定量蛋白質組學數據,作者進行對應時間點的WB實驗(圖4G-I),證實了在后期發育階段相應蛋白上調的表達水平。
細胞粘附分子是另一類重要的蛋白質,在神經元發育中起關鍵作用。它們介導軸突尋路和軸突-樹突接觸形成,并進一步調節樹突棘形態和突觸可塑性。在作者的組學數據集中定量了82種細胞粘附蛋白,包括Cntn1、NrCAM、Nrxn2、NCAM1和NCAM2等(圖 4E),其中有 24個蛋白存在于Cluster3(圖3A)。
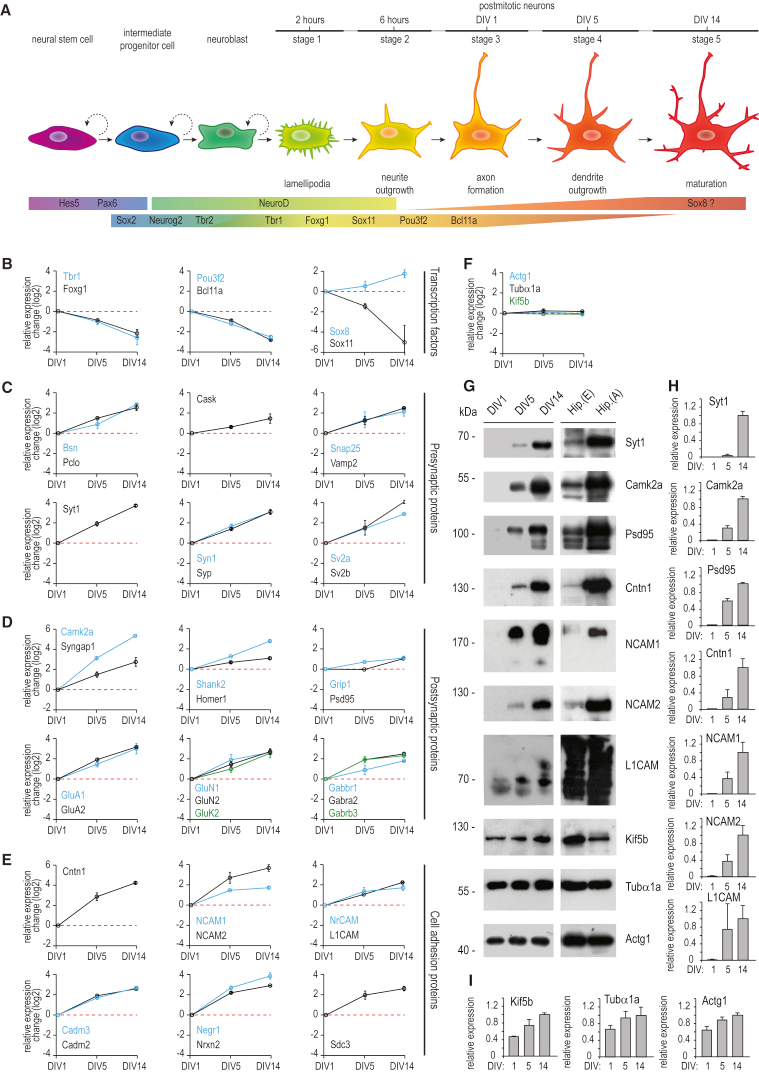
圖4 神經元分化過程中蛋白質表達的變化
4. 關鍵細胞粘附分子NCAM1
神經細胞粘附分子1(NCAM1)是細胞粘附蛋白的重要成員,屬于免疫球蛋白樣細胞粘附分子家族,是最豐富的神經元粘附蛋白之一。NCAM1以NCAM1基因的可變剪接產生的三種主要同種型表達,兩種同種型(NCAM140和NCAM180)是跨膜蛋白,NCAM120是錨定的糖基磷脂酰肌醇(GPI)(圖5A)。作者首先通過WB實驗確定來自DIV2至DIV21培養的大鼠海馬神經元提取物中的同種型特異性蛋白質表達水平(圖 5B )。和報道的研究結果一致,NCAM180是神經元中NCAM1表達的主要同種型,定量分析顯示NCAM180在DIV5和DIV16顯示兩個主要的蛋白質表達峰(圖 5C),這和組學定量結果一致,表明除了其在突觸可塑性中的作用外,NCAM1在神經元發育的早期階段(DIV5)可能也很重要。
為了進一步研究發育中的神經元(DIV1-DIV14)的NCAM1分布,作者進行了免疫熒光實驗,結果表明NCAM1在2-3階段細胞(DIV1)中顯示出一些染色,其主要存在于軸突生長錐中。有趣的是,在DIV4-DIV5,許多神經元在樹突生長錐中顯示出強烈的NCAM1積累,在后期(DIV6-DIV8)又逐漸消失(圖5D-F)。
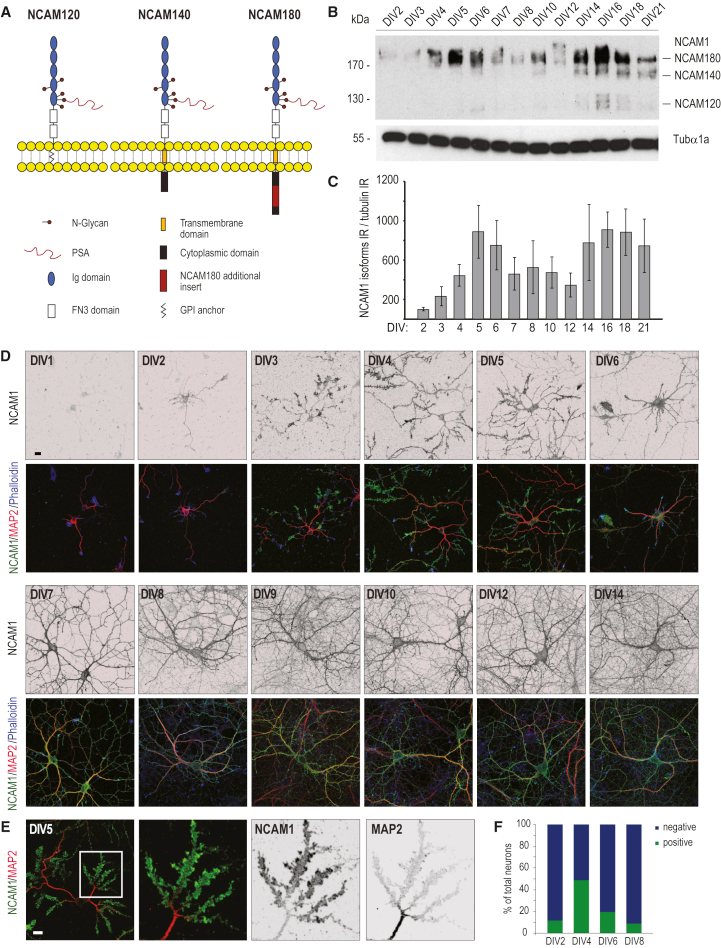
圖5 NCAM1及其在整個神經元發育過程中的表達
由于NCAM1在樹突生長錐中累積,作者進一步研究了NCAM1在樹突發育過程中的作用。基于NCAM180 mRNA大鼠序列設計并產生三種特異性短發夾RNA(shRNA)序列,進行敲低實驗。如WB和免疫染色實驗結果所示,所有三種shRNA(shRNA_NCAM1#1、shRNA_NCAM1#2和shRNA_NCAM1#3)將蛋白質水平降低80%(圖6A–C),量化顯示軸突的長度(圖 6E)和樹突的長度(圖6F)與對照神經元相比顯著降低,即NCAM1的缺失降低主樹突、總樹突和樹突分支的長度。
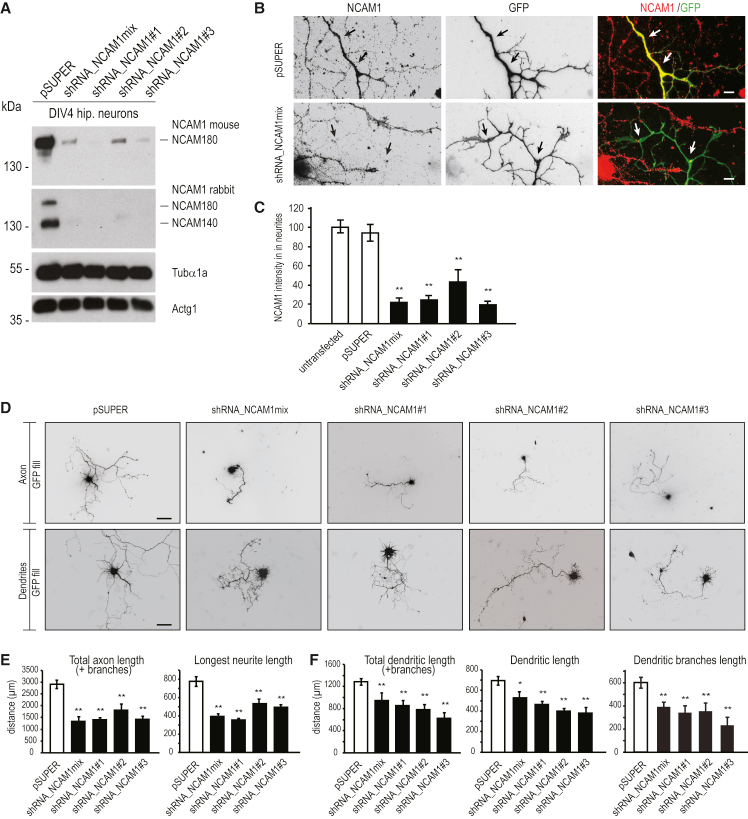
圖6 shRNA敲低神經元NCAM1
為了研究NCAM1影響樹突發育的機制,作者在神經元中搜索了NCAM180結合配偶體,并使用另外兩種同種型作為對照,通過親合層析-質譜(AP-MS)分析鑒定真正的NCAM1結合伴侶,結果發現NCAM1互作的多為肌動蛋白-細胞骨架相關蛋白。值得注意的是,每個用作誘餌的NCAM1同種型的長度與鑒定的每種特異性肌動蛋白結合蛋白的相對豐度直接相關,從而證實NCAM180是參與調節樹突中肌動蛋白動力學的主要參與者(圖7A)。PPI分析可以清晰表明NCAM180與肌動蛋白的緊密聯系(圖7B),且這些肌動蛋白多存在于Cluter3并在DIV5上調(圖 7C),表明它們可能在NCAM1信號傳導中強烈配合。
為了研究NCAM1和肌動蛋白細胞骨架之間的潛在關系(圖7D),作者利用穩定肌動蛋白纖維以促進肌動蛋白聚合藥物Jasplakinolide處理NCAM1敲除細胞株。結果表明加入jasplakinolide可部分挽救由NCAM1耗竭引起的神經元發育缺陷(圖7E-G),與對照神經元相比,在jasplakinolide處理的神經元中總樹突長度、初生樹突長度和樹突分支長度顯著增加。這表明,NCAM1通過在樹突生長錐中促進肌動蛋白絲保持穩定來促進樹突發育。
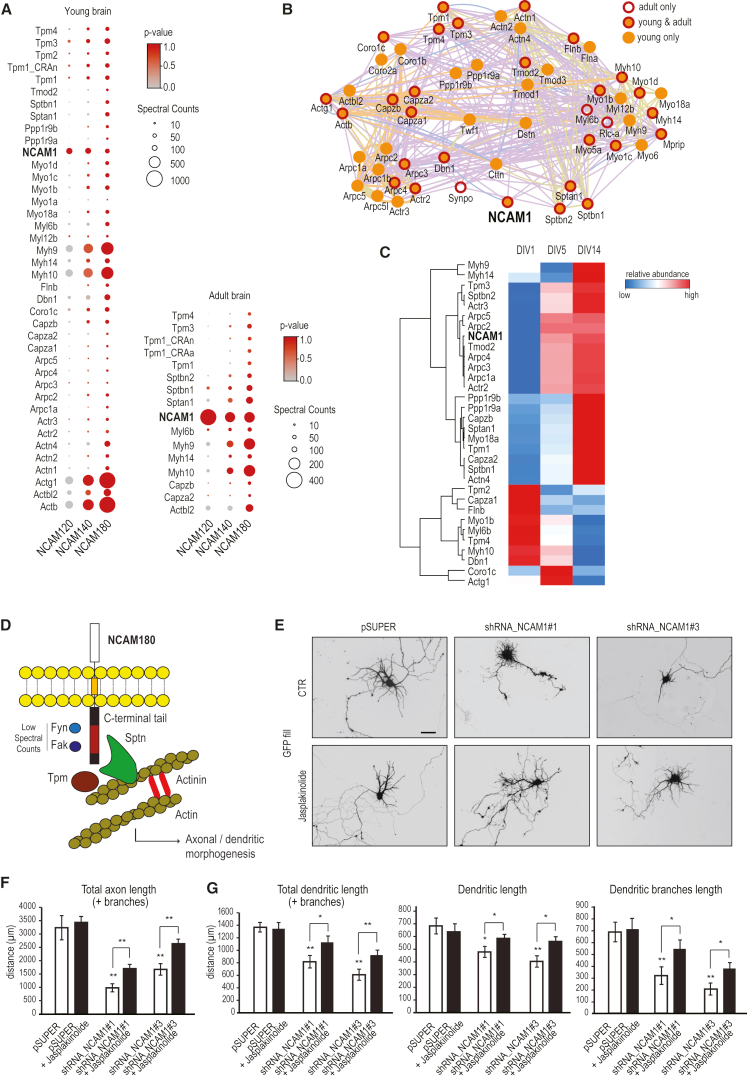
圖7 NCAM1及其在肌動蛋白細胞骨架穩定中的作用
研究小結
本研究中作者定量到4534個蛋白質,超過三分之一蛋白在神經元分化期間經歷了超過2倍的表達變化,表明神經元蛋白質組的廣泛重塑。其中神經細胞粘附分子1(NCAM1)能夠通過在樹突生長錐中促進肌動蛋白絲保持穩定來促進樹突發育。可見,定量蛋白質組學成為研究海馬神經元發育特定階段差異表達蛋白質分析的基礎研究工具,將來可更好地用于神經發育的任何特定分子機制,進一步補充研究人員對神經元蛋白質動力學的理解。
解析文獻
Christian K. Frese, Marina Mikhaylova, et al. Quantitative Map of Proteome Dynamics during Neuronal Differentiation. Cell Reports, 2017, 18(6): 1337-1586
參考文獻
1. Boersema, P.J., Raijmakers, R., et al. Multiplex peptide stable isotope dimethyl labeling for quantitative proteomics. Nat. Protoc, 2009, 4, 484–494.
2. Choi, H., Larsen, B., et al. SAINT: probabilistic scoring of affinity purification-mass spectrometry data. Nat. Methods, 2011, 8, 70–73.
3. Low, T.Y., van Heesch, S., et al. Quantitative and qualitative proteome characteristics extracted from in-depth integrated genomics and proteomics analysis. Cell Rep, 2013, 5, 1469–1478.
4. Sharma, K., Schmitt, S., et al. Cell type- and brain region-resolved mouse brain proteome. Nat. Neurosci, 2015, 18, 1819–1831.
上一條:菌落PCR步驟詳解及注意事項
下一條:SWATH-MS的那些事
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










