磷酸化修飾組學揭示三陰乳腺癌激酶表達譜
信息來源:金開瑞 作者:genecreate 發布時間:2018-12-27 14:19:39
題目:In vivo phosphoproteomics reveals kinase activity profiles that predict treatment outcome in triple-negative breast cancer
磷酸化蛋白質組揭示三陰乳腺癌激酶表達譜
期刊:Nature Communications
影響因子:12.353
主要技術:磷酸化蛋白質組
研究背景
三陰乳腺癌(TNBC)是雌激素受體、孕激素受體及人表皮生長因子受體2免疫組化檢測均呈陰性的乳腺癌,,而且預后較差。目前高通量基因組學已經揭示TNBC存在明顯的異質性,但是并沒有發現和其有高度相關的高滲透致癌基因,基于蛋白質組學的研究方法,特別是翻譯后修飾中磷酸化修飾組學,可能會有新的發現。
研究內容及結果
1. TNBC復發患者激酶表達譜
作者選擇了TNBC治療3年后復發和超過12年未復發的患者,共計34名進行磷酸化蛋白質組學檢測分析,鑒定到 >9000個磷酸化肽段和> 10000個非冗余磷酸化位點,映射到2643個蛋白質,共有702個差異磷酸化肽段(圖1),其中159個磷酸化肽段表達量顯著上調,63個新位點之前未見報道。作者希望找到驅動磷酸化的一些激酶,激酶富集分析(KSEAS)得到11種激酶(圖2,圖3),如圖2a,顯示激酶CLK1在復發患者中活性增加。隨后作者通過體外激酶實驗聯合質譜驗證,確定6種激酶(PRKCE、 c-Kit、p-ERK (Thr202/Tyr204)、p-P70S6K (Thr389)、p-PNKP (Ser114/Thr118)、CDK6)在TNBC復發患者中表達量上調且和復發有很高的相關性(圖4)。
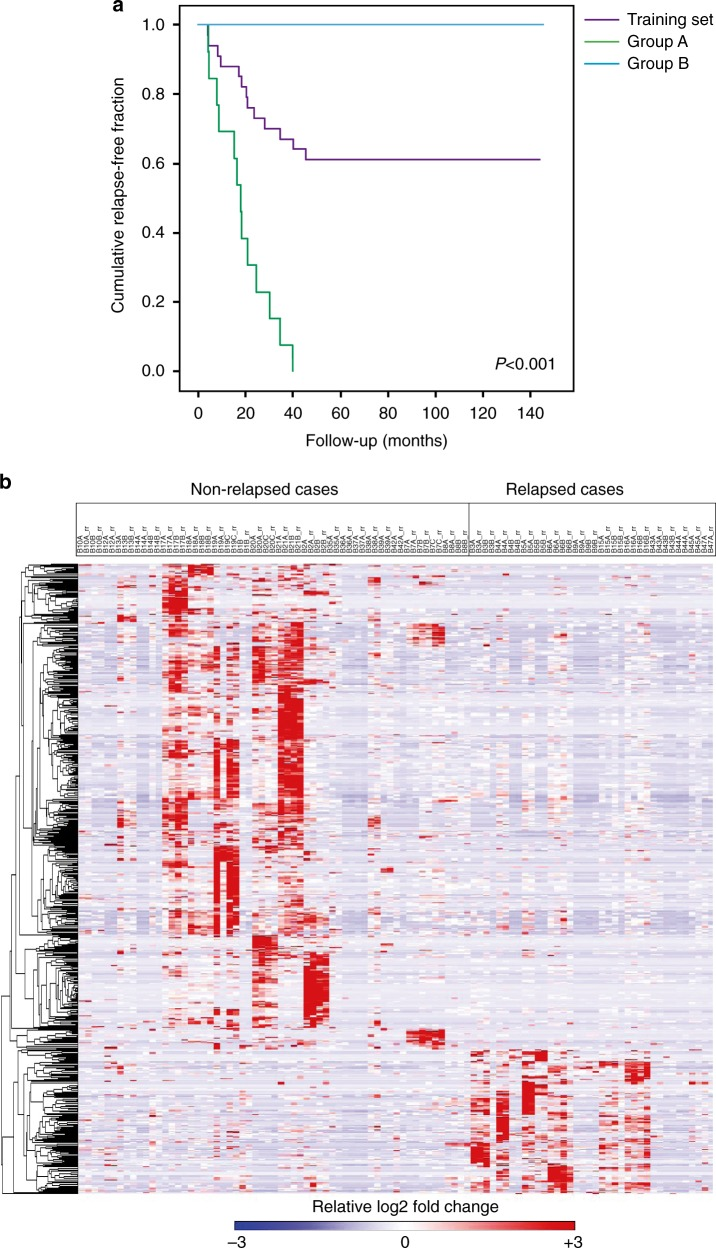
圖 1 磷酸化蛋白質組學表達譜

圖2 驅動TNBC磷酸化的激酶

圖3 TNBC細胞系染色
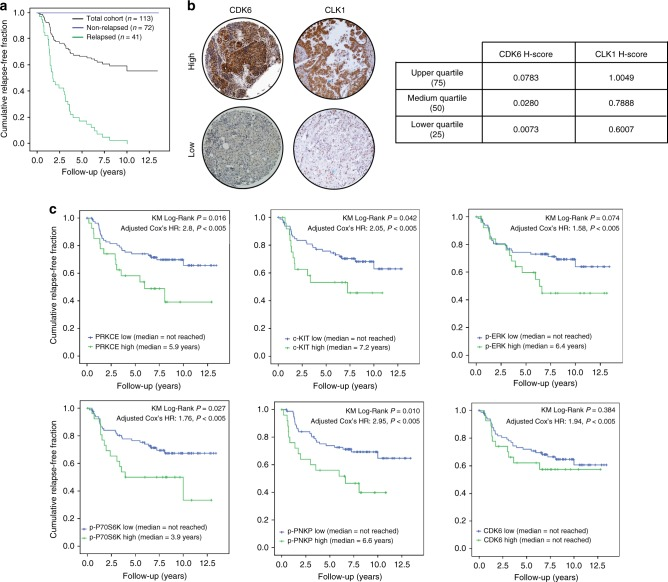
圖4 激酶組獨立驗證
2. TNBC基因組學分析
隨后作者深入分析6種激酶在113名患者中的活性,發現大致可以分為兩組:81例患者中至少一種激酶呈現高活性(12年后復發率47%);32例患者的6中激酶全部呈現低活性(12年后復發率6.5%)(圖5a)。即6種激酶全部呈低活性的患者具有良好的預后,反之,如果存在任何一種激酶呈現高活性,預后效果則會降低。由于每位患者激活的激酶數量差異很大,在64種可能的激酶激活模式中,作者發現有12種模式與TNBC復發相關(圖5b)。雖然大多數模式涉及激酶的不同組合,但是更常見的模式是顯示激活單一激酶。作者隨后比較了乳腺癌最常見的基因突變與激酶激活模式的對應關系,發現不同激酶的激活方式可以和不同的基因突變對應上(圖5c)。因此,作者認為基于激酶激活方式對TNBC患者進行分類比基于基因突變的分類更為重要。

圖5 激酶組與基因組的臨床相關性
3. 臨床模型中靶向激活激酶
目前有多種分析方法可以基于多組學數據篩選候選藥物,作者希望基于目前的數據,開發一種簡單快速的候選藥物篩選方法。因此,作者選擇了不同TNBC細胞系(10例人TNBC腫瘤細胞、1例小鼠乳腺癌4T1移植瘤模型和2例人源腫瘤異種移植(PDX)模型)檢測6種激酶的表達水平(圖6a),并根據這些靶標的表達水平選擇感興趣的組合藥劑。
目前市場上已有的藥劑表現出有限的單藥體外活性(圖6b),其中三種臨床級藥物palbociclib、imatinib和GDC-0994分別靶向CDK6、c-Kit和ERK。三種非臨床級藥物A12B4C3、H-EAVSLKPT-OH和Ly2584702分別靶向PNKP、PRKCE和P70S6K。由于這6中激酶沒有統計學意義上的共線性,且許多TNBC患者具有超過一種激酶的激活,這表明沒有特定的激酶對TNBC腫瘤發展是必需的,且這些激酶可以在腫瘤中共存,形成侵襲性TNBC表型。因此,作者選擇將臨床級藥劑兩兩聯合使用,發現可以顯著降低靶標磷酸化水平(圖6c)。這表明,根據驅動侵襲性TNBC生物學的激酶組合有助于在TNBC臨床模型中篩選相對特異的雙聯體,為臨床模型提供有效的治療方案。

圖6 激酶表達水平驗證及體內藥效學實驗
文章小結
作者利用磷酸化蛋白質組學簡化TNBC分類,發現6種和TNBC患者預后相關激酶,其中有任何一種激酶存在高活性的患者預后效果降低,而激酶全部呈低活性的患者則具有良好的預后。基于6種激酶的靶向藥物兩兩聯合,有助于篩選TNBC臨床治療候選藥物。
解析文獻
Zagorac Ivana, Fernandez-Gaitero Sara, et al. In vivo phosphoproteomics reveals kinase activity profiles that predict treatment outcome in triple-negative breast cancer [J]. Nature Communications, 2018, 9: 3501.
相關服務
蛋白質磷酸化是生物體中較常見的一種蛋白質翻譯后修飾方式,它可以通過激發、調節諸多信號通路進而參與調控生物體的生長、發育、逆境應激、疾病發生等多種生命過程,所以磷酸化一直是生物學研究的重點與熱點。蛋白提取之后酶解成肽段,對肽段進行富集,然后結合LC-MS/MS對樣本進行定量分析。
金開瑞采用主流的TiO2 / IMAC富集方法、特異性高、富集效率好,結合常用的定量技術可對不同樣品間的磷酸化水平差異進行定量比較。
下一條:多種PCR方法介紹
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










