免疫印跡實驗步驟及問題解決
信息來源:金開瑞 作者:genecreate 發布時間:2019-01-21 16:43:54
一、實驗步驟
試劑和緩沖液
1x RIPA 緩沖液: 50 mM Tris, 150 mM NaCl, 0.1% SDS, 0.5% SDS, 1% Triton X-100 或NP40.
1x PBS 緩沖液: 137 mM NaCl, 2.7 mM KCl, 2.7 mM Na2HPO4, 2.7 mM KH2PO4, pH 7.4
BCA或Bradford蛋白分析試劑盒
1.5 M Tris緩沖液 (pH 8.8): 90.68 g Tris-HCl to ddH2O, 500 ml溶液pH調節到8.8
1.0 M Tris緩沖液 (pH 6.8): 60.58 g Tris-HCl to ddH2O, 500 ml溶液pH調節到6.8
10% APS: 100 mg AP 溶于1 ml ddH2O。 用前準備
10% SDS: 10 g SDS溶于100 ml ddH2O。
1x Tris-甘氨酸電泳緩沖液: 25 mM Tris, 230 mM 甘氨酸 (pH 8.3), 0.1% SDS。
3x SDS蛋白加樣緩沖液: 150 mM Tris (pH 6.8), 6% SDS, 30% 甘油, 30 mM EDTA和0.2% 溴酚藍
1x TTBS: 25 mM Tris(pH 7.5): 0.15 M NaCl, 0.05% Tween-20, 0.001% 硫柳汞
1x 轉移緩沖液: 3 g Tris, 14.4 g甘氨酸和200 ml甲醇,加ddH2O 到1L
樣品準備
細胞培養樣品
貼壁細胞
去除培養基,用1X PBS沖洗去掉殘留培養基
加入預冷的400 ul-1 ml 1X RIPA緩沖液/100 mm平皿。 在冰上孵育5-10 min。
完全刮下細胞并轉移到在冰上預冷的1.5 ml離心管中。
(可選)充分混勻或超聲處理。
4°C下12,000 rpm離心10-15 min并收集上清
總蛋白用前需儲存在-20°C。
懸浮細胞
(可選)取出100 ul細胞培養也進行細胞計數。
將細胞轉移到預冷的1.5 ml或15 ml離心管2000 rpm 4°C離心5 min。
去除培養基并用1 ml預冷的1x PBS重懸細胞,然后轉移到1.5 ml離心管中。
2000 rpm 4°C離心5 min。
用1 ml預冷的RIPA 緩沖液/107細胞重懸細胞
細胞懸液在冰上孵育并搖床30 min,或充分混勻或超聲處理。
4°C 12000 rpm離心10-15 min收集上清備用。
總蛋白需要在用前儲存在-20°C 。
組織
組織準備和定量。將組織切成小塊。
加入500-600 ul預冷的1x RIPA緩沖液/100 mg 組織。
將組織充分混勻
4°C 12000 rpm離心15-20min。
收集上清。
總蛋白在用前應儲存在-20°C。
蛋白定量
Bradford分析和BCA分析請查看來邦的綜述 蛋白定量。
SDS-PAGE
聚丙烯酰胺凝膠
6%-15% 分離膠上注入5%的濃縮膠并插上梳子(10或者15孔)。
| 分離膠濃度(%) | 蛋白大小范圍(kDa) |
| 8 | 25-200 |
| 10 | 15-100 |
| 12.5 | 10-70 |
| 15 | 12-45 |
| 20 | 4-40 |
表1: 蛋白分離范圍由分離膠濃度決定。
上樣和電泳
2X SDS蛋白上樣緩沖液與蛋白樣品1:1充分混勻。
注膠前先將樣品在50-60°C預熱。預染Marker可用于監控蛋白分離和轉移效率。
在1X Tris-甘氨酸緩沖液在60-120V跑電泳1-3小時
| 分離膠(10ml) | 濃縮膠(3ml) | |||||
| 6% | 8% | 10% | 12% | 15% | 6% | |
| H20 | 5.3 | 4.6 | 4.0 | 3.3 | 2.3 | 2.1 |
| 30% 丙烯酰胺混合物* | 2.0 | 2.7 | 3.3 | 4.0 | 5.0 | 0.5 |
| 1.5M Tris(pH 8.8) | 2.5 | 2.5 | 2.5 | 2.5 | 2.5 | 1.0M Tris (pH 6.8) 0.38 |
| 10% SDS | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.03 |
| 10% APS | 0.1 | 0.1 | 0.1 | .1 | 0.1 | 0.03 |
| TEMED | 0.008 | 0.006 | 0.004 | 0.004 | 0.004 | 0.003 |
表2:分離膠(10ml)和濃縮膠(3ml)的制備方案
蛋白轉移
將蛋白轉移到PVDF或NC*膜上進行抗體檢測
1.將電泳材料,如膠、whatman紙和海綿放入1X轉移緩沖液中預先浸潤.
2.PVDF膜應在甲醇中預先孵育10秒到1分鐘,然后移入轉移緩沖液中
3.將材料按如下順序放置:板(黑色面), 海綿, Whatman紙, 膠, 膜, Whatman紙, 海綿, 板(亮面).
4.將轉移裝置安置好,黑色面對應黑色電極。
5.轉移到冷的1X轉移緩沖液中.電轉電流和時間應該根據電泳裝置的廠家說明推薦設置。
* NC膜不能用甲醇孵育。
將膜放入溶有5%脫脂奶粉的1x TBST中25°C孵育1小時 (或在搖床上4°C孵育過夜)。
抗體孵育
1.按照推薦濃度或根據結果優化濃度,將一抗溶于1X TBST+3% BSA中。
2.在4°C孵育過夜或更長時間,或者在室溫下4小時。
3.回收一抗,保存在4°C。然后在室溫下在搖床上沖洗膜三次,每次5-10 min。
4.將二抗放入1X TBST中稀釋,然后室溫下孵育膜1小時,或4°C搖床上2-4小時。
5.在室溫搖床上用TBST洗三次,每次10 min
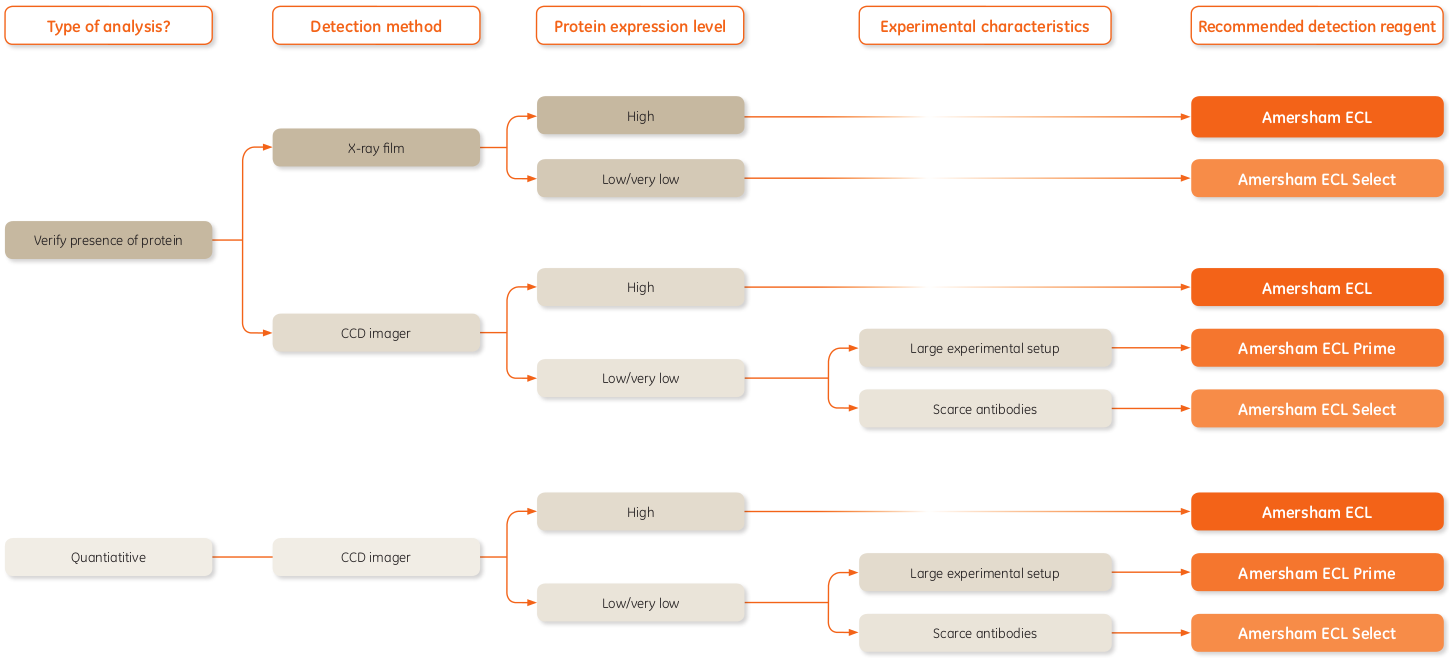
ECL+ 系統和X-ray膠卷被用于HRP標記的二抗。
二、問題解決
沒有信號,可能原因
檢測的二抗用錯了(明確一抗制備的宿主)
一抗或二抗的濃度太低(提高濃度再試一次)
一抗不能識別檢測物種的蛋白(檢查一抗的特異性)
上樣蛋白量太少(增加樣品的量)
轉移效率太低(改進轉移實驗步驟。確保PVDF膜用之前用甲醇預孵育)
一抗已經被用很多次了(使用重新稀釋的一抗)
封閉時間太長或者洗滌次數太多(減少封閉時間和洗滌次數)
檢測試劑盒失效(加入陽性對照并確保試劑盒有效)
疊氮化鈉可能抑制二抗(溶解緩沖液中應避免使用疊氮化鈉)
一抗或二抗的孵育時間太短(延長孵育時間)
背景太亮
封閉時間太短或者封閉緩沖液有問題(延長封閉時間或者用BSA代替脫脂奶粉)。
一抗或二抗濃度太高。(降低抗體濃度)
洗脫不充分(增加洗脫次數)
孵育溫度太高 (確保一抗在4°C孵育)
膜使用錯誤或者膜已經干了 (避免膜變干)
白色條帶或者信號消失很快
一抗或二抗濃度太高(降低抗體濃度)
條帶彎曲
電泳電壓太高,或者電泳過程中緩沖液溫度太高。(降低電壓,電泳緩沖液置于冷的環境中)
條帶彌散
一抗或二抗濃度太高(降低抗體濃度)
上樣蛋白量太大 (降低上樣量)
空白區域
轉移不均衡(確保膜均衡的貼到膠上,沒有氣泡)
非特異性信號
一抗或二抗濃度太高(降低抗體濃度)
條帶臟或者模糊
平衡時間不夠,或者膠與膜的接觸不均衡。(確保膠沒問題,改進轉移步驟)
禿斑
膠與膜之間有氣泡(確保膠與膜之間沒有氣泡)
條帶大小與理論不符
一抗特異性差(更換一抗)
一些蛋白可能移動與理論大小差別較大。
不能闡釋可能的翻譯后修飾
翻譯后修飾例如多聚(ADP-核糖基)-PAR鏈(它能夠介導蛋白分子帶負電荷)不能通過SDS-PAGE分別。 不過它們能通過CTAB-PAGE分開。 CTAB, 溴化十六烷基三甲基銨 ((C16H33)N(CH3)3Br, cetyltrimethylammonium bromide, hexadecyltrimethylammonium bromide)是一種基于氨陽離子的表面活性劑。
上一條:抗體稀釋和抗體滴度解析
下一條:引物合成的步驟及方法介紹
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










