Cancer Research!NFAT1- NDEL1軸將成為神經膠質瘤治療策略的重要目標
信息來源:金開瑞 作者:genecreate 發布時間:2019-05-27 09:50:08
題目:NFAT1-mediated regulation of NDEL1 promotes growth and invasion of glioma
stem-like cells
期刊:Cancer Research(IF=9.13)
合作技術:細胞系培養和鑒定
研究背景
神經膠質瘤是成人最常見、最難治療的原發性腦腫瘤,其腫瘤的發生發展與膠質瘤干細胞(GSCs)相關,因此針對這種細胞亞群的研究有利于膠質瘤的臨床治療。鑒于GSCs位于特殊的微環境中,且其誘導和維持機制在很大程度上仍然是未知的,所以揭示促使GSCs遷移侵襲和自我更新的分子機制對于GSCs定向治療的發展具有重要意義。在本篇文獻中,作者深入研究活化T細胞-1的鈣反應轉錄因子(NFAT1)在GSCs中的作用,并報告了一種新的GSCs維持途徑,即NFAT1- NDEL1軸(NDEL1是NFAT1下游靶點,神經發育蛋白1)將成為神經膠質瘤治療策略的重要目標。
研究內容及結果
1. 神經膠質瘤的臨床病理特征與NFAT1表達量有關
在前期膠質母細胞瘤中NFAT1系列研究基礎上,作者根據TCGA(癌癥和腫瘤基因圖譜)和Gravendeel(公開的臨床數據集)統計發現,神經膠質瘤的間充質亞型中NFAT1表達水平高于其他幾種亞型(圖1A),且NFAT1表達不僅與干細胞基因(CD44/Vimentin)和間質轉化相關基因(REL/LYN/TGFBR2)表達顯著相關,也與膠質瘤的預后較緩相關(圖1B-1C)。接下來,從新鮮的臨床多形性膠質母細胞瘤(GBM)等樣本中分離出GSCs,進行細胞系鑒定和富集培養,通過RT-qRCR和免疫熒光染色實驗發現,NFAT1高表達與膠質瘤的惡性亞型和GSCs的生長侵襲有關(圖1D-1E)。
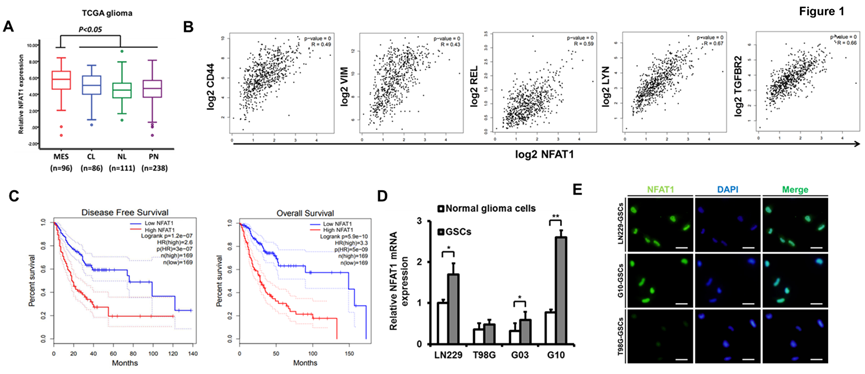
圖1 NFAT1表達與神經膠質瘤的臨床病理特征的關系
2. NFAT1影響GSCs的生長和侵襲
為確定NFAT1對GSCs的生理影響,一方面,采用兩個獨立的shRNAs分別去轉導高表達NFAT1的LN229和G10 GSCs細胞。WB結果證實,其中一個NFAT1 shRNAs (shNFAT1-2) 轉導LN229和G10 GSCs后NFAT1減少了80%以上(圖2A);體外細胞活性測定和流式分析顯示,NFAT1沉默顯著地降低GSCs的活性并誘導細胞凋亡(圖2B-2C);此外,通過傷口愈合分析、Transwell分析和三維球體侵入分析得到,shNFAT1-2感染GSCs后細胞遷移和侵入行為顯著減少,且GSCs球體形成能力下降(圖2D-2G)。
另一方面,在基礎水平較低的T98G和G03 GSCs中實現NFAT1過表達(圖3A)。通過一系列細胞生物學檢測得到,NFAT1過表達顯著地增強細胞活性并抑制凋亡(圖3B-3C)、增加了GSCs的遷移和入侵(圖3D-3F);同時電鏡圖顯示NFAT1刺激GSCs的神經球的形成過程(圖4G)。
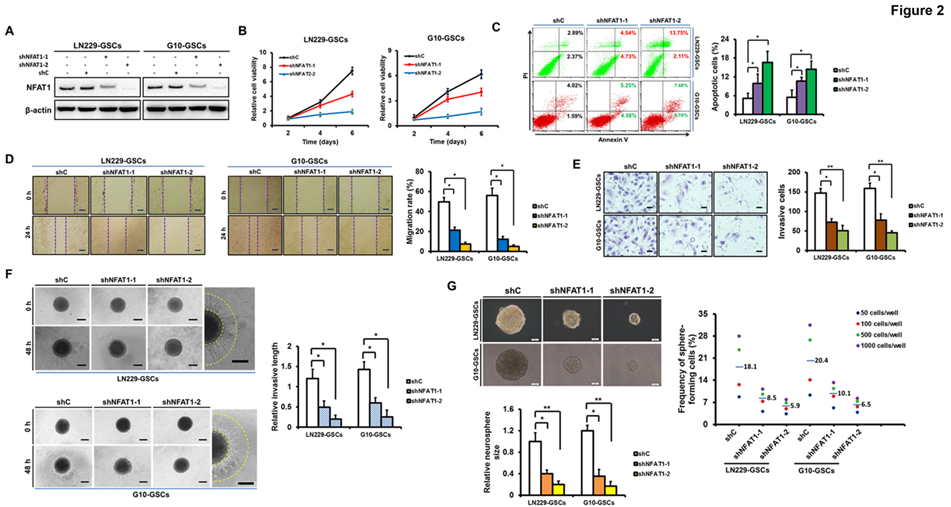
圖2 NFAT1的沉默抑制GSCs的生長和侵襲
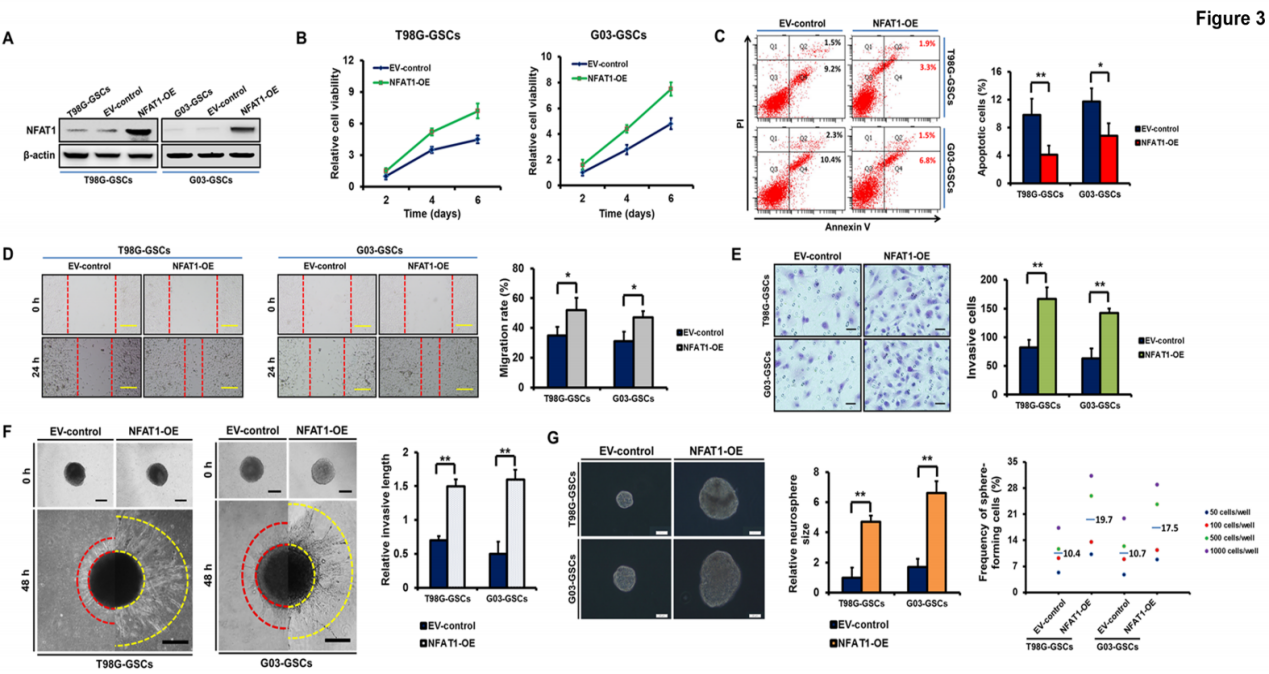
圖3 NFAT1的過表達促進GSCs的生長和侵襲
3. NFAT1對體內GSCs腫瘤生長具有重要意義
采用顱內小鼠模型,探究NFAT1沉默和過表達對體內GSCs腫瘤生長的影響。大腦切片染色結果顯示,與對照shRNA相比,NFAT1的敲除組顯著地抑制顱內腫瘤生長(圖4A-4B);Kaplan–Meier生存曲線顯示T98G和G03 GSCs的細胞生存率增加,進而可推測出NFAT1 shRNAs(shNFAT1-1和shNFAT1-2)將更有效地延長小鼠生存期(圖4C-4F)。綜上所述,NFAT1在體外和體內都促進GSCs的腫瘤發生。
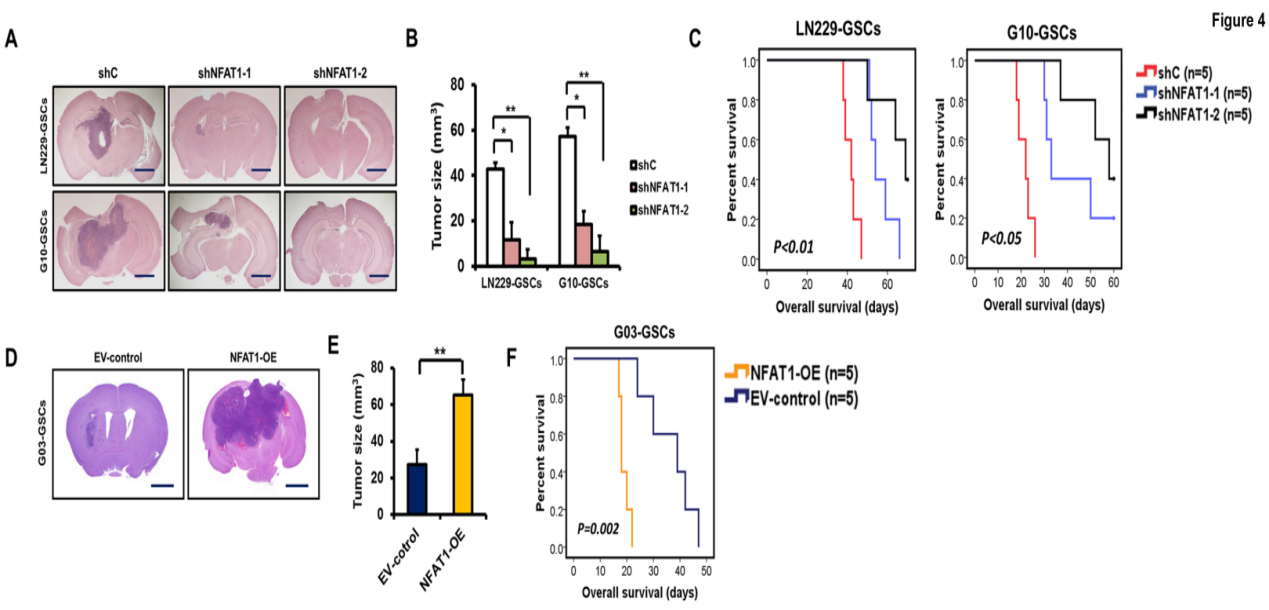
圖4 NFAT1表達影響體內GSCs的生長
4. NDEL1鑒定為NFAT1下游靶基因
通過開展轉錄組測序來確定NFAT1的潛在下游靶點,從熱圖數據中分別初篩出50個NFAT1沉默后下調基因和NFAT1過表達后上調的基因,上述均有可能是NFAT1介導的腫瘤促進基因(圖5A-5B);結合TCGA和Gravendel數據集的生物信息學分析,發現NDEL1表達量在復發性GBMs中顯著地上調且涉及到間質過渡和干度增加的生理過程(圖5C-5D),同時也發現間充質GSCs細胞的NDEL1表達水平明顯高于原神經性GSCs細胞(圖5E-5F)。與此同時,在挖掘REMBRANDT補充數據集后發現,NDEL1表達不僅與GBMs低存活率相關,還參與膠質瘤的惡性進展。
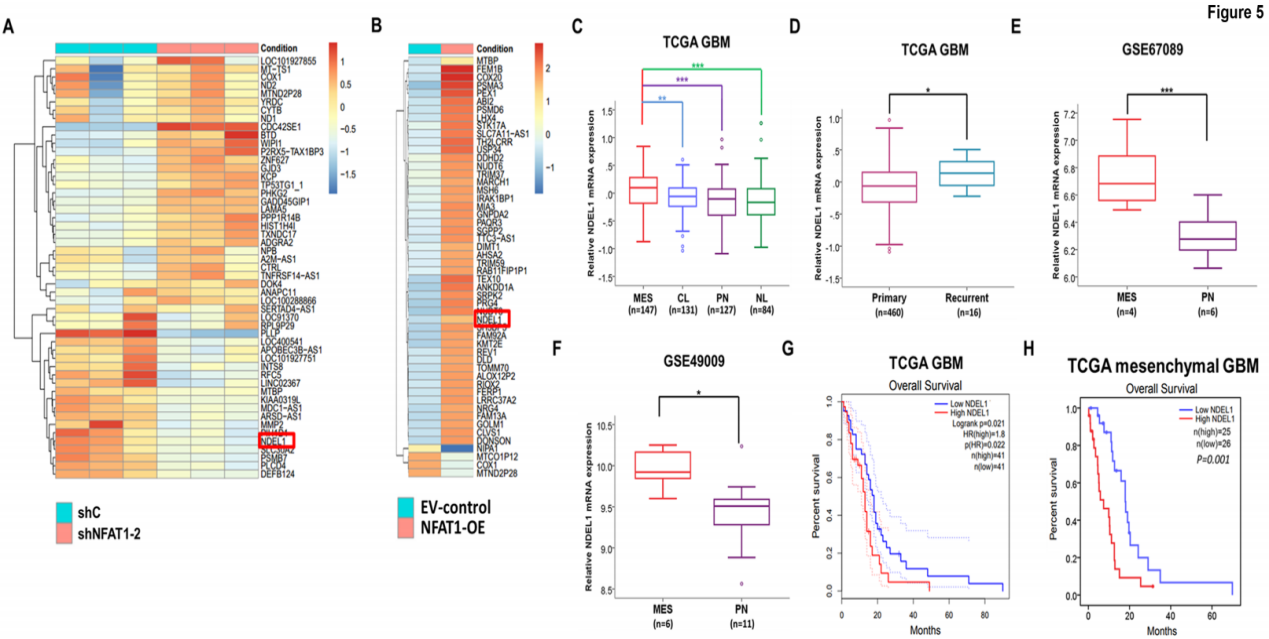
圖5 神經膠質瘤表達與臨床病理特征的關聯
5. NDEL1由NFAT1轉錄調節并參與GSCs的發生發展
通過蛋白質印跡分析初步驗證轉錄組的數據,NFAT1的沉默顯著地降低了NDEL1的表達,且NFAT1的過表達顯著地增加了NDEL1的表達(圖6A-6B);雙標記免疫熒光染色測定出在G10 GSC中NFAT1對NDEL1具有調節作用(圖6C-6D);采用熒光素酶分析法檢測NAFT1對NDEL1啟動子活性的影響,結合ChIP-qPCR芯片分析得出NFAT與NDEL1啟動子結合(圖6E-6G)。鑒于NDEL1在GSCs生長和入侵中的作用機制尚未確定,由此使用兩個獨立的shRNAs來穩定地沉默G10 GSCs的NDEL1(圖6H);陸續通過WB檢測、流式分析、基質凝膠分析、三維球體侵入分析得到,NDEL1的沉默顯著降低了G10 GSCs的侵入能力,且在很大程度上抑制了G10 GSCs的自我更新能力(圖6I-6M)。
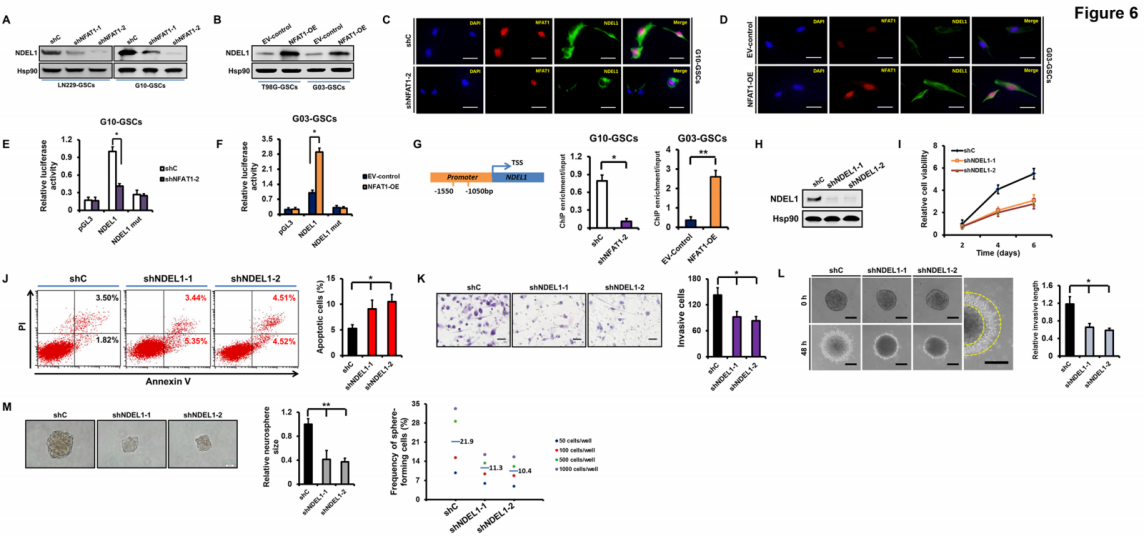
圖6 NDEL1由NFAT1的轉錄調節
6. 在NFAT1沉默的GSCs中NDEL1重新表達可部分恢復腫瘤生長和侵襲
為了進一步研究NFAT1是否通過調節NDEL1表達來部分支持GSCs的攻擊行為,作者在FAT1沉默的G10 GSCs中建立NDEL1重新表達的體系(圖7A),發現NDEL1重新表達可部分恢復GSCs的生理活性,并減少了NFAT1沉默誘導的細胞凋亡(圖7B-7C)。根據基質凝膠分析、三維球體侵入分析和神經球形成檢測,得到NFAT1敲除后抑制的GSCs侵襲作用被NDEL1重新表達所挽救(圖7D-7E)并恢復了自我更新能力(圖7F-7G);此外,大腦切片染色等體內驗證實驗表明,通過NDEL1重新表達僅部分非完全地緩解NFAT1基因敲除后體內腫瘤生長的抑制效應,也很可能涉及更多的未知途徑。
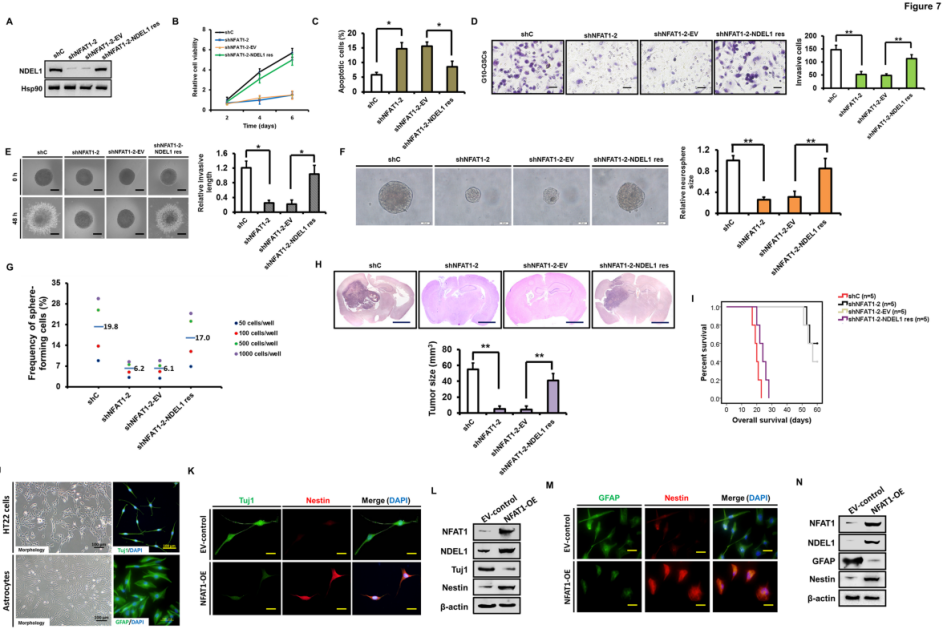
圖7 在NFAT1沉默的GSCs中NDEL1重新表達可恢復體外和體內的腫瘤生長
文章小結
本文旨在探討NFAT1在神經膠質瘤中的調節機制,通過基因敲除和過表達進行初步驗證,發現NFAT1表達與膠質瘤的侵襲性表型和生存率相關;RNA測序顯示NFAT1的缺失與NDEL1表達關聯;結合挽救實驗說明NFAT1調控了NDEL1的啟動子活性,NFAT1-NDEL1信號上調后激活ERK去提高GSCs干細胞標志物的蛋白水平和細胞分化水平。綜上所述,NFAT1通過調節NDEL1去部分控制GSCs的生長和侵襲,以NFAT1-NDEL1軸為靶點可為膠質瘤患者提供較大可能的治療機會。
解析文獻
Jiang Y, Song YF, Wang R, et al. NFAT1-mediated regulation of NDEL1 promotes growth and invasion of glioma stem-like cells. Cancer Res. 2019 Apr 2,DOI: 10.1158/0008-5472.CAN-18-3297.
最新動態
-
09.23
中藥的現代詮釋:外泌體如何革新傳統醫學?
-
07.02
1+1>2!深度解析RNA測序數據挖掘邏輯和后期實驗設計思路,輕松研獲10+ SCI
-
07.01
“稻”亦有道——盤點近期水稻研究的重大突破
-
06.28
科學與美學的結合體:植物亞細胞定位技術詳解
-
06.28
“聚焦新質生產力,激發科研新動能”|LCA躋身蛋白互作研究的新銳力量
-
06.05
知無不“研”|一文讀懂免疫共沉淀技術(Co-IP)
-
05.14
四大研究利器(Co-IP、BIFC、Y2H、GST pull-down)助力速配蛋白互作“最佳拍檔”
-
05.14
高效、精準、直觀、實時——取經“蛋白互作研究翹楚”BIFC!
-
05.14
轉染效率低、干擾效果差、重復性欠佳...siRNA研究頻遇“攔路虎”怎么辦?
-
04.22
一文讀懂EMSA技術核心要點,讓“emsa” 秒變“easy”










